国家药监部门或将收回二类医械审评审批权
《医疗器械监督管理条例修正案(草案送审稿)》公开征求意见,将第二类医疗器械产品注册由省、自治区、直辖市药品监督管理部门审评审批改由国务院药品监督管理部门审评审批,对审批程序也进行了一定优化。
健康点healthpoint - 国家药监部门,二类医械审评审批权 - 2018-06-29
5000亿医械市场:中国市场增速已远超全球,但还有这些问题亟待解决!
近日,艾媒咨询发布的一项研究报告显示,我国医疗器械市场规模在2017年已经达到了759亿美元,占全球市场规模的18.8%,且连续六年增速高于全球市场规模增速。
E药经理人 - 医械审评,临床试验豁免 - 2019-03-04
第一只靴子落下:国务院正式向海南医疗特区下放医疗器械审批权
国务院正式下文向海南省下放了部分进口医疗器械的审批权,而更受关注的进口新药直进海南,大概率也只是时间问题。
健康点healthpoint - 国务院,医疗器械审批权,海南 - 2018-04-09
中央:深化药品医械审批改革
昨天(7月19日),中央深改组第37次会议召开,审议通过了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称《意见》)。 2015年8月,国务院曾经印发《关于改革药品医疗器械审评审批制度的意见》,标志着药品医疗器械审评审批制度改革的全面启动。 此项改革实施已有1年多,业内不
赛柏蓝器械 - 药械,改革 - 2017-07-20
2019药监新动作,医械政策大变动!
2019年2月3日,国家市场监督管理总局印发了《国家市场监督管理总局2019年立法工作计划》,推进市场监管制度的规范,其中医械行业也安排了立法项目,并会对整个行业产生深刻的影响。
国家市场监督管理总局 - 医械政策,变动,改革 - 2019-02-14
2016年全国医械企业猛增近15万家
《2016年度食品药品监管统计年报》显示,与2015年度相比,全国竟然多出近15万家二、三类医疗器械经营企业!
赛柏蓝器械 - 医械企业,统计年报 - 2017-05-24
CFDA药品“优审”政策更新,国家临床研究中心成重点
CFDA更新《关于鼓励药品创新实行优先审评审批的意见》,新划定两类药品进入优先审评审批行列,国家临床医学研究中心为更新中的一大重点。在利好不断的政策大环境下,国家临床研究中心有可能打破医、研、企藩篱,加速药械上市流程吗?
健康点healthpoint - “优审”政策,国家临床研究中心 - 2017-12-29
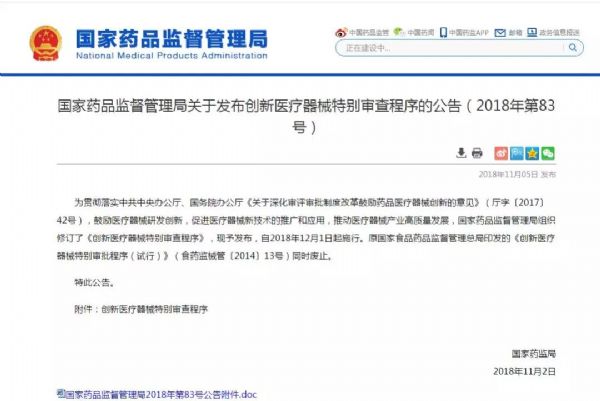
药监局:创新医疗器械特别审查程序正式发布
11月2日,国家药品监督管理局发布了关于发布创新医疗器械特别审查程序的公告(2018年第83号),旨在鼓励医疗器械研发创新,促进医疗器械新技术的推广和应用,推动医疗器械产业高质量发展。
药监局 - 创新医疗器械,特别审查程序 - 2018-11-06
上海今起实施医疗器械优先审批流程 为医疗技术创新开辟“绿色通道”
上海今起实施《第二类医疗器械优先审批程序》,急需及重点医疗器械将优先审评,为医疗技术创新开辟一条“绿色通道”。
文汇报 - 医疗器械,优先审批 - 2017-09-01
食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知
食品药品监管总局关于印发创新医疗器械特别审批程序(试行)的通知食药监械管〔2014〕13号 各省、自治区、直辖市食品药品监督管理局: 为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,总局组织制定了《创新医疗器械特别审批程序(试行)》,现印发给你们,请遵照执行。
MedSci原创 - 食品药品监管总局,医疗器械 - 2014-02-09
上海这六类医疗器械可优先审批
自9月1日起,上海已开始正式实施《第二类医疗器械优先审批程序》,临床急需以及列入国家、本市科技重大专项或重点研发计划的医疗器械将在审批过程中单独排序,优先审评,确保能够在安全的情况下以最快的速度上市,该优先审批程序的有效期
医谷 - 医疗器械,审批程序 - 2017-09-18
关于药品注册审评若干问题的讨论
作者:杏林中人 本文来自蒲公英 一、效率低下原因探析 目前国内药品审批现状受到社会各界的广泛诟病,各个层面都不满意。主要问题是审评效率太低,不少企业资料报上去以后,在漫长的排队等待过程中,从充满期望,到失望,到绝望。我们经常批评国内企业不注重研发投入,实际上药品审批的低效率,在很大程度上遏制了企业投入研发的热情。
蒲公英微信 - 药品,注册 - 2014-11-30
CFDA发布《创新医疗器械特别审批程序(试行)》
为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,国家食品药品监督管理总局(CFDA)组织制定了《创新医疗器械特别审批程序(试行)》,并于2月7日公布文件,文件全文如下: 创新医疗器械特别审批程序(试行) 第一条为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,
CFDA - CFDA,创新医疗器械,特别审批程序 - 2014-02-12
为您找到相关结果约236个