Ann Intern Med:FDA批准的口服DAA药物有很高的HCV治愈率
在我国健康人群抗HCV阳性率为0.7%~3.1%,约3800万人。
生物谷 - 丙肝,DAA,HCV,基因型,利巴韦林 - 2017-03-21
吉利德的丙肝药物Epclusa在儿童感染患者中应答率超过90%,喜获FDA批准
此次FDA的批准将使Epclusa成为美国批准首个针对成人和儿童HCV感染患者的泛基因型、无蛋白酶抑制剂的治疗方案。
MedSci原创 - 吉利德,儿童患者,丙肝药物Epclusa - 2020-03-20
美国批准首个PKU酶药物
Biomarin的Palynziq已被批准为首个用于治疗美国成年人罕见的脑部威胁性遗传病苯丙酮尿症(PKU)的酶疗法。
MedSci原创 - PKU酶药物 - 2018-05-25
JAMA:FDA加速批准药物的预批准研究和批准后研究有无差别?
2017年8月,发表在《JAMA》的一项研究调查了美国食品药物管理局(FDA)加速批准授权药物预批准和批准后研究的特点。研究结果显示,验证性试验和预批准试验具有相似的设计元素,加速批准授权药物的有效性通常在批准后3年内的批准后研究中得到证实。
环球医学 - 药物,FDA - 2017-09-18
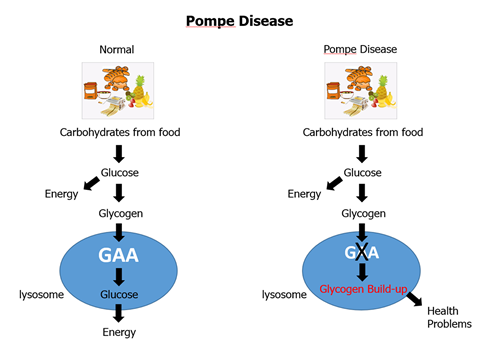
美国批准庞贝病药物Nexviazyme
赛诺菲近日宣布,其酶替代疗法 (ERT) Nexviazyme (avalglucosidase alfa) 已获得美国食品和药品监督管理局 (FDA) 的批准,用于治疗迟发性庞贝病 (LOPD)。
MedSci原创 - 庞贝病,Nexviazyme - 2021-08-09
FDA批准过度流口水药物Xeomin
Merz Neuroscience的Xeomin已成为美国食品和药物管理局批准的第一个治疗过度流口水的药剂。Xeomin是一种神经毒素,在III期数据的基础上被批准用于止血,显示与安慰剂相比,未
MedSci原创 - Xeomin,FDA - 2018-07-04
FDA批准AML新靶向治疗药物
近日,美国食品和药物管理局(FDA)批准enasidenib用于治疗具有特异基因突变的复发性或难治性急性髓性白血病(AML)成年患者。该药物被批准用于伴随诊断,即RealTime IDH2 Assay,其用于检测AML患者中IDH2基因的特异性突变。
环球医学 - FDA,AML - 2017-08-02
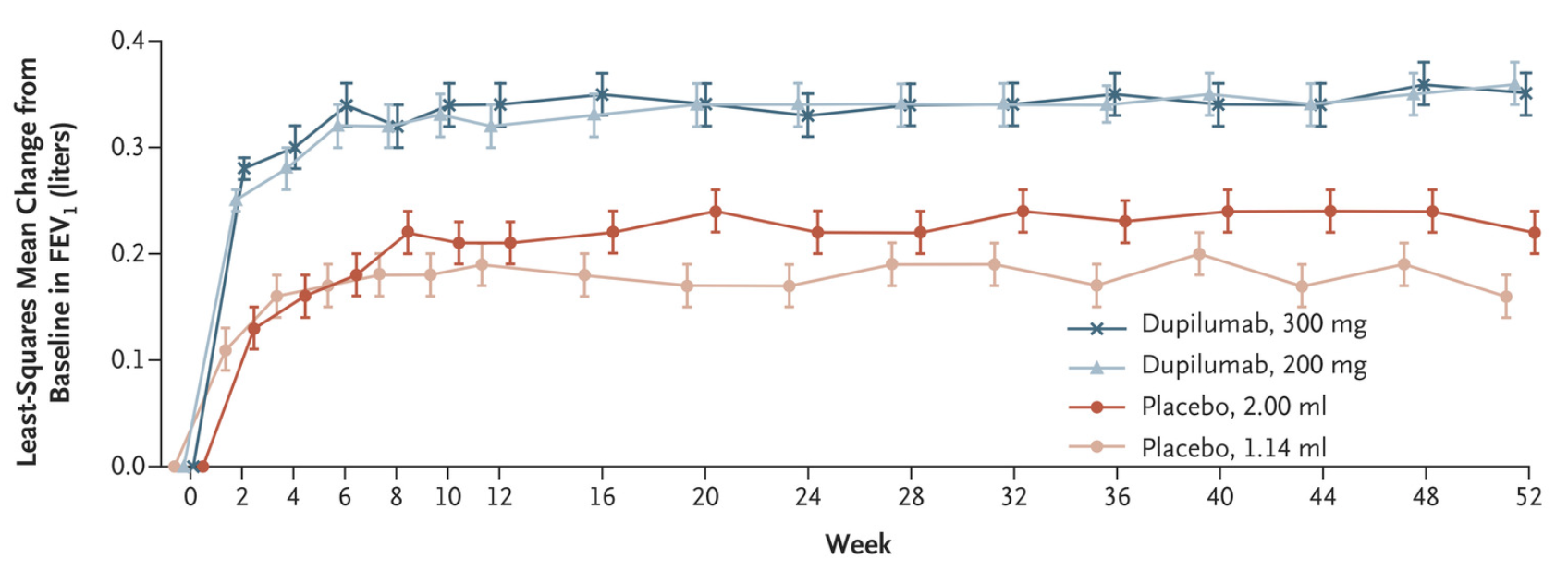
NHS批准的新型哮喘药物dupilumab被称为“神奇药物”
与接受安慰剂的患者相比,接受dupilumab治疗的患者的严重哮喘发作率显著降低(严重哮喘发作年化率:dupilumab vs. 安慰剂 0.37 vs. 1.08),并且肺功能和哮喘控制也更好。
MedSci原创 - 哮喘,Dupilumab - 2021-10-18
武田抗体偶联药物Adcetris获日本批准
武田(Takeda)宣布,抗体偶联药物Adcetris(brentuximab vedotin)获日本卫生劳动福利部(MHLW)批准,用于2种适应症:(1)复发性或难治性CD30阳性霍奇金淋巴瘤(HL)
生物谷 - 新药,FDA - 2014-01-20
FDA批准遗传性肥胖药物Imcivree
FDA已批准Imcivree(setmelanotide)用于前阿片黑素细胞皮质激素(POMC)或瘦素受体(LEPR)遗传缺陷的肥胖人群的慢性体重管理。
MedSci原创 - 遗传性肥胖,Imcivree,瘦素受体(LEPR),前阿片黑素细胞皮质激素(POMC) - 2020-11-28
Vivus公司ED药物Avanafil获EMA批准
2012年3月26日,Vivus公司(Nasdaq:VVUS)今天宣布,欧洲药品管理局(EMA)已批准其研究性药物avanafi上市许可申请(Marketing Authorization ApplicationEMA对avanafi的批准,是基于VIVUS公司成功完成的一项广泛III期研究
生物谷 - 新药,FDA - 2012-04-16
EMA批准抗体偶联药物Adcetris上市
Adcetris是近30多年来首个获批用于复发性或难治性CD30阳性霍奇金淋巴瘤的靶向性治疗药物,对于CD30阳性复发性或难治性霍奇金淋巴瘤患者来说,欧盟委员会对于Adcetris的有条件上市许可批准
医学论坛网 - 抗体偶联药物,Adcetris,霍奇金淋巴瘤 - 2012-12-04
默沙东眼部药物Zioptan获得FDA批准
默沙东周一表示,美国食品和药物管理局批准其Zioptan(tafluprost滴眼液)作为治疗某些种类青光眼的解决方案。
MedSci原创 - Zioptan,FDA - 2012-02-15
欧盟批准新型糖尿病复合药物
欧盟委员会于近日批准二肽基肽酶-4抑制剂利格列汀(Linagliptin)+二甲双胍的复合剂型,用于与健康饮食和运动一起治疗成人2型糖尿病。 该药物主要用于单用二甲双胍治疗时已增至最大耐受剂量血糖控制仍欠佳的患者,或那些正接受利格列汀联合二甲双胍治疗的患者。它可单用或与磺脲类药物联用。美国食品与药物管理局(FDA)已于今年初批准该药在美上市。 一项纳入791例成人2型糖尿病患者的随
医学论坛网 - 二肽基肽酶-4抑制剂,利格列汀,二甲双胍,磺酰脲类药 - 2012-07-31
为您找到相关结果约500个