FDA授予IgE单抗Xolair突破性疗法认定,治疗食物过敏
罗氏和诺华公司的过敏药物Xolair(omalizumab)获得FDA突破性认定,用于治疗新的适应症--食品过敏。
MedSci原创 - IgE单抗,Xolair,食物过敏 - 2018-08-14
Xolair被认为是治疗食物过敏的“突破性”疗法
罗氏(Roche) /诺华(Novartis)的Xolair在美国被授予突破性地位,用于治疗意外接触食物过敏原后出现的严重过敏反应。Xolair (omalizumab)是一种针对免疫球蛋白E的单克隆抗体,已在美国获准用于治疗哮喘和慢性特发性荨麻疹(无已知病因的慢性荨麻疹)。
MedSci原创 - Xolair,食物过敏 - 2018-08-15
诺华单抗药索雷尔(Xolair)新适应症获欧盟批准
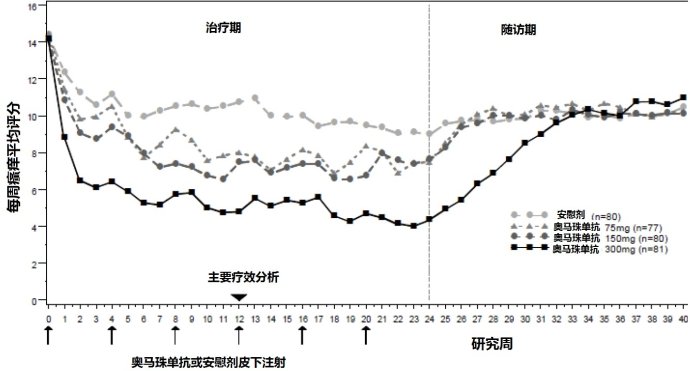
诺华(Novartis)3月6日宣布,单抗药Xolair(omalizumab,奥马珠单抗)获欧盟委员会(EC)批准,作为一种附加药物,用于对H1抗组胺药物反应不足的12岁及以上青少年和成人慢性自发性荨麻疹Xolair的获批,是基于3项关键性III期注册研究(ASTERIA I、ASTERIA II、GLACIAL)的积极及一致性结果
生物谷 - 欧盟,诺华,单抗,索雷尔 - 2014-03-07
诺华/Genetech单抗Xolair获FDA批准用于6至11岁哮喘患儿
诺华及罗氏旗下Genetech公司近日宣布,其合作研发的单抗药物Xolair获FDA批准扩大适用年龄范围,用于中至重度持续性哮喘的儿童患者的治疗。Xolair (omalizumab)是一种实验性单克隆抗体,靶向结合免疫球蛋白E(IgE),该药可以通过减少IgE和细胞激活机制的下游效应来抑制组胺诱导的炎症反应。Xolair最初在2003年获得FDA批准,用于12岁以上儿童及成人中至重度过敏性哮
生物谷 - 哮喘患儿 - 2016-07-13
诺华的ligelizumab在自发性荨麻疹研究中未能击败Xolair
顶线结果显示,虽然高亲和力单克隆抗 IgE 抗体 ligelizumab 在第 12 周取得了优于安慰剂的效果,但与 Xolair 相比却不明显。
MedSci原创 - 慢性自发性荨麻疹 - 2021-12-22
DA确定罗氏/诺华哮喘重磅药物索雷尔(Xolair)提高心血管风险
早在2009年,FDA首次表达了对服用哮喘药物索雷尔(Xolair,通用名:omalizumab,奥马珠单抗)患者中发生的心脏发作和中风报道表达了关注,该药由罗氏(Roche)和诺华(Novartis)近日,FDA将采取行动,在Xolair标签上添加新的警告信息,确认该药与心血管疾病风险相关。 根据FDA公告,该警告信息不会以“黑框警告”纳入Xolair标签,而是纳入产品标签的“不良反
生物谷 - 哮喘重磅药物 - 2014-10-08
Xolair预填充注射器获得欧盟委员会批准用于所有适应症
诺华公司近日宣布,欧洲委员会(EC)已批准Xolair®(omalizumab)预填充注射器(PFS)自我给药方案,允许患有严重过敏性哮喘(SAA)和慢性自发性荨麻疹(CSU)的患者自行进行治疗。
MedSci原创 - Xolair,预填充注射器,自我注射 - 2018-12-14
诺华IgE单抗Xolair治疗慢性鼻窦炎的两项III期研究达到主要临床终点
诺华宣布其Xolair(omalizumab)用于标准治疗无充分反应的、患有鼻息肉的慢性鼻窦炎患者的两项III期研究,同时符合共同主要终点和关键的次要目标。
MedSci原创 - 诺华,IgE单抗,Xolair,慢性鼻窦炎,III期研究 - 2019-06-03
Alvotech与BiosanaPharma达成全球独家许可协议,共同开发Xolair®(奥马珠单抗)的拟议生物仿制药(AVT23)
专注于为全球患者开发和生产生物仿制药的全球性生物制药公司已经与BiosanaPharma达成了一项全球独家许可协议,共同开发Xolair®(奥马珠单抗)的拟议生物仿制药AVT23(也称BP001)
网络 - 制药公司,奥马珠单抗,生物制药公司,生物仿制药AVT23 - 2022-02-09
CURR OPIN ALLERGY CL:奥马珠单抗治疗可能改变哮喘的自然过程?
背景:过敏性哮喘,这是最常见的哮喘表型,主要是一种慢性炎性疾病,表现为血清IgE水平升高和特定-IgE抗常见的过敏原。尽管中/高剂量吸入性激素(ICS)的使用联合其它药物控制,但哮喘儿童仍然呈现不受控制的中度/重度症状。哮喘指南建议奥马珠单抗作为针对这类孩子的辅助治疗,最近的证据表明了这类单克隆抗体mAb抗IgE的疗效和安全性。最近的研究结果:哮喘不能治愈,当前可用的治疗无法改变疾病的自然过程。而
MedSci原创 - 奥马珠单抗,哮踹 - 2015-04-29
诺华的新型IgE单抗Ligelizumab在自发性荨麻疹试验中胜过奥马珠单抗
诺华(Novartis)宣布了IIb期剂量研究的结果,该研究发现与300 mg的Xolair(奥马珠单抗)相比,使用Ligelizumab(QGE031)治疗的慢性自发性荨麻疹患者症状效果更加显着。
MedSci原创m - 诺华,新型IgE单抗,Ligelizumab,自发性荨麻疹,奥马珠单抗 - 2019-10-14
奥马珠单抗在欧洲获批,成为治疗严重慢性鼻-鼻窦炎的唯一IgE单抗
Xolair(omalizumab,奥马珠单抗)是唯一获批靶向抗免疫球蛋白E(IgE)单抗。
MedSci原创 - Xolair(omalizumab,奥马珠单抗),伴有鼻息肉的严重慢性鼻-鼻窦炎(CRSwNP) - 2020-08-07
慢性自发性荨麻疹(CSU)新药!诺华新一代IgE抗体ligelizumab获美国FDA突破性药物资格!
诺华(Novartis)近日宣布,美国食品和药物管理局(FDA)已授予ligelizumab(QGE031)突破性药物资格,用于治疗对H1抗组胺治疗应答不足的慢性自发性荨麻疹(CSU)患者。
生物谷 - 荨麻疹,慢性自发性荨麻疹 - 2021-01-16
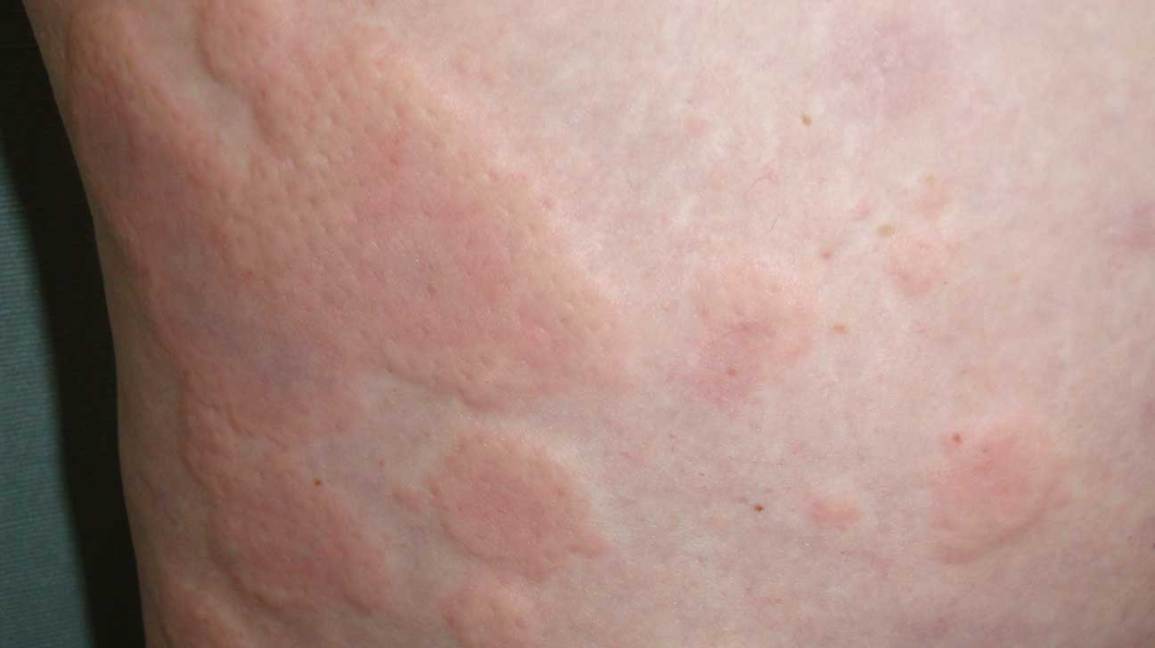
FDA批准奥马珠单抗(Xolair)用于慢性特发性荨麻疹
• 近50%的CIU患者在使用获批剂量的H1-抗组胺药治疗后疗效不佳,对于此类患者Xolair®是目前第一个且唯一一个获美国批准的治疗药物 • CIU在美国以外的地区被称为CSU,这是一种严重的皮肤病• Xolair®获得美国食品药品管理局批准用于治疗CIU的治疗严格依照欧盟批准Xolair®用于CSU的治疗准则
MedSci原创 - 荨麻疹,奥马珠,FDA - 2014-04-13
NEJM的:诺华的IgE单抗Ligelizumab在慢性自发性荨麻疹的III期临床中完胜奥马珠单抗
在最近的一项研究中,诺华的ligelizumab(以前称为QGE031)显示出更高的抑制慢性自发性荨麻疹中主要病原性免疫球蛋白E(IgE)/FcεRI的功效,并且ligelizumab比Xgair的亲和力高88倍。
MedSci原创 - NEJM的,诺华,IgE单抗,Ligelizumab,慢性自发性荨麻疹,Ⅲ期临床,奥马珠单抗 - 2020-01-09
为您找到相关结果约30个