FDA批准首款RNAi药物Onpattro用于治疗hATTR
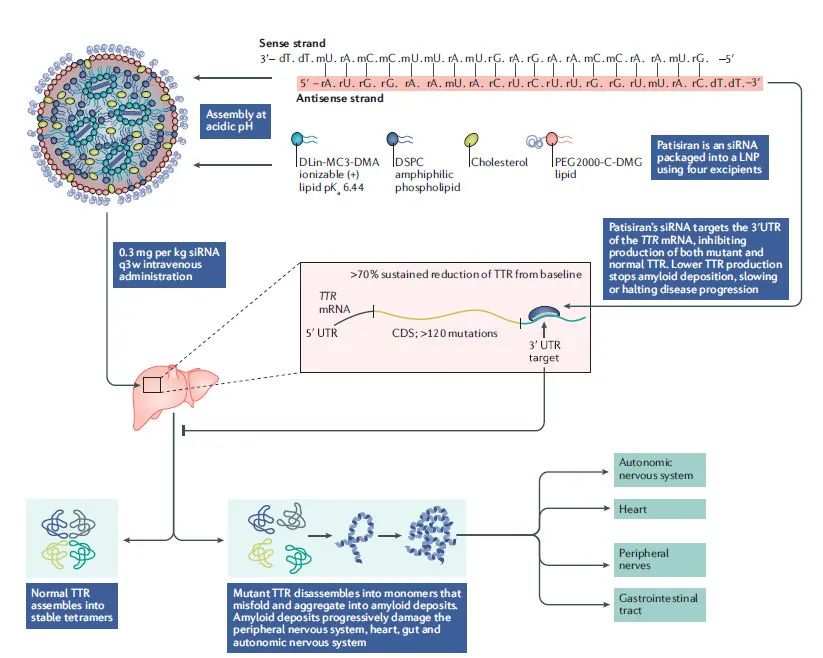
日前,美国FDA批准了一项具有里程碑意义的基因疗法,针对罕见病遗传性转甲状腺素蛋白淀粉样变性或hATTR(一种神经病变或神经损伤)的基因疗法。hATTR影响了全球约50000人,是一种罕见、使人衰弱且常
MedSci原创 - FDA,药物,RNAi - 2018-08-12
Alnylam的RNAi疗法Onpattro获得欧盟批准治疗hATTR
Alnylam Pharmaceuticals于本周四宣布,该公司开发的Onpattro(patisiran)的获得欧盟的上市许可,用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)的1或2期多发性神经病变的成年患者
MedSci原创 - RNAi,hATTR,欧盟 - 2018-08-30
首次RNAi基因治疗药物获得FDA批准用于治疗hATTR成年患者
美国食品和药物管理局于本周五批准Alnylam Pharmaceuticals的Onpattro(patisiran)用于治疗遗传性转甲状腺素淀粉样变性(hATTR)引起的多发性神经病变的成年患者,这是美国首个批准用于治疗该适应症的药物
MedSci原创 - siRNA,基因治疗,FDA,hATTR - 2018-08-12
Alnylam的RNAi疗法Vutrisiran获得FDA快速通道指定,治疗hATTR淀粉样变性
RNAi疗法vutrisiran靶向和沉默特定的信使RNA,从而阻止野生型和突变型甲状腺素转运蛋白(TTR)的产生。
MedSci原创 - hATTR淀粉样变性,FDA快速通道指定,RNAi疗法vutrisiran - 2020-04-15
英国NICE批准Alnylam的基因干扰药物Onpattro用于治疗hATTR淀粉样变性
英国国家健康与护理卓越研究所(NICE)在2018年12月发布 "否"之后,重新建议使用Alnylam的Onpattro(patisiran)治疗遗传性转甲状腺素介导的淀粉样变性病(hATTR淀粉样变性
MedSci原创 - Alnylam,基因干扰药物,Onpattro,hATTR淀粉样变性 - 2019-07-10
FDA批准vutrisiran治疗成人遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病(hATTR-PN),这是第5款siRNA药物
近日,全球领先的 RNAi 疗法公司
bioSeedin柏思荟 - 遗传性转甲状腺素蛋白淀粉样变性 - 2022-06-17
英国NICE推荐Akice公司的反义寡核苷酸药物Tegsedi用于治疗罕见遗传病:转甲状腺素相关的淀粉样蛋白变性
英国国家健康与护理卓越研究所(NICE)推荐Akcea Therapeutics的Tegsedi(inotersen),用于治疗罕见遗传病:遗传性转甲状腺素相关的淀粉样蛋白变性(hATTR),该建议推荐将该药物用于
MedSci原创 - Akice,反义寡核苷酸药物,Tegsedi,hATTR,转甲状腺素相关的淀粉样蛋白变性 - 2019-04-17
2022 爱尔兰和英国专家共识:遗传性ATTR淀粉样变性患者的临床和遗传性评估
遗传性转甲状腺素介导的淀粉样变性 (hATTR)依据TTR基因突变及其在个体的外显率而有所不同致使临床表现具有异质性而难以早期诊断。本文主要针对遗传性ATTR淀粉样变性患者的临床和遗传性评估提供共识建
Adv Ther - 遗传性ATTR淀粉样变性 - 2022-04-16
FDA批准反义RNA疗法上市 治疗难治神经疾病
Pharmaceuticals和其下属公司Akcea Therapeutics联合宣布,美国FDA批准双方联合开发的反义寡核苷酸药物Tegsedi(inotersen)上市,用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTRhATTR是一种致命的进行性遗传病,它是由于患者体内
MedSci原创 - FDA,RNA - 2018-10-06
Circulation:转甲状腺素淀粉样变性心肌病——老年人的又一杀手
研究人员共纳入711位野生型ATTR-CM患者,其中205位是携带V1221突变的遗传性ATTR-CM(V122I-hATTR-CM),另118位为非-V122I-hATTR-CM。
MedSci原创 - 转甲状腺素淀粉样变性心肌病,ATTR-CM,心衰,V122I - 2019-07-06
FDA批准lumasiran治疗原发性高草酸尿症1型,Alnylam的RNAi帝国再下一城!
近日,FDA批准了Alnylam的RNAi药物lumasiran的新适应症,通过降低血浆中的草酸盐水平来治疗原发性高草酸尿症1型(又称Ph1)这种罕见的遗传性疾病。主要基于一系列临床试验结果,见:NE
会会药咖 - FDA,RNAi药物,Lumasiran,原发性高草酸尿症1型 - 2022-10-11
RNAi疗法再遭重创 Alnylam新疗法因患者意外死亡被迫中止
著名基因疗法开发者Alnylam公司最近再遭重创。公司开发的用于治疗遗传性ATTR淀粉样蛋白病变新药revusiran临床III期研究被爆治疗组患者死亡率过高而被迫中止。受此影响,公司股价暴跌41%,RNAi疗法再受重创。此次,总部位于麻省坎布里奇的Alnylam公司在声明中表示,其数据分析委员会(DMC)告知管理层,认为这一疗法目前的风险-收益已经严重失衡并建议公司管理层立刻中止这一研究。此次临
生物谷 - Alnylam新疗法,RNAi疗法 - 2016-10-10
NEJM:Inotersen治疗遗传性运甲状腺素蛋白淀粉样变性
Inotersen可改善遗传性运甲状腺素蛋白淀粉样变性患者的神经系统功能和生活质量
MedSci原创 - 遗传性运甲状腺素蛋白淀粉样变性,反义核苷酸,Inotersen - 2018-07-05
为您找到相关结果约28个