Cancer Discov:新靶点助力告别免疫逃逸!
2019-12-18 Ruthy 转化医学网
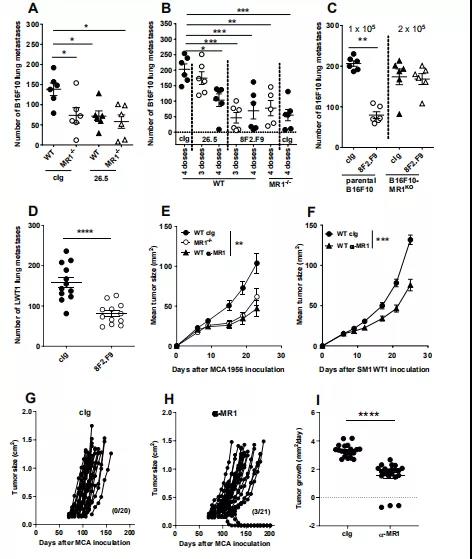
机体免疫系统具有免疫监视功能。当体内出现恶变细胞时,免疫系统能够识别并特异性清除这些“非己”细胞。但肿瘤细胞仍可在机体内生长,表明肿瘤细胞能够逃避宿主免疫系统的攻击,或是通过某种机制使机体下调有效的抗肿瘤免疫应答。其中肿瘤细胞自身修饰变化引起的抑制细胞活化是肿瘤免疫逃逸的重要机制,目前虽已发现不少相关通路,但仍只是冰山一角。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Dis#
25
#新靶点#
21
#ISC#
31