诺华的Adakveo获得FDA批准治疗镰状细胞性疼痛
2019-11-18 不详 MedSci原创
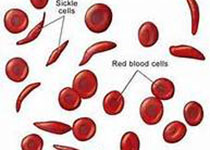
诺华宣布其Adakveo(crizanlizumab)获得美国食品药品监督管理局(FDA)批准,用于减少镰状细胞病患者的疼痛发作频率。该药物以前称为SEG101,已被批准用于减少16岁及以上患有该疾病的成年和儿科患者的血管闭塞性危机(VOC)。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言









#细胞性#
32
#Adakveo#
32
#FDA批准#
33
#ADA#
30
#诺华#
28
#镰状细胞#
49