这篇Nature文章被媒体夸大报道了吗?
2017-03-06 佚名 BioArt
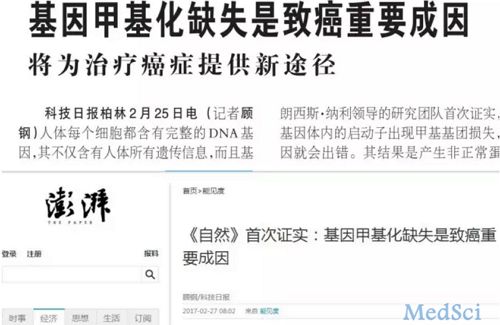
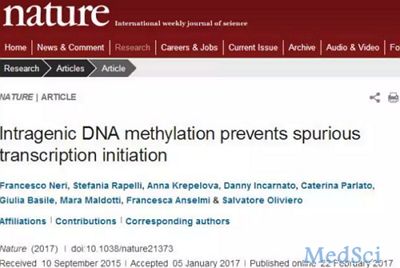
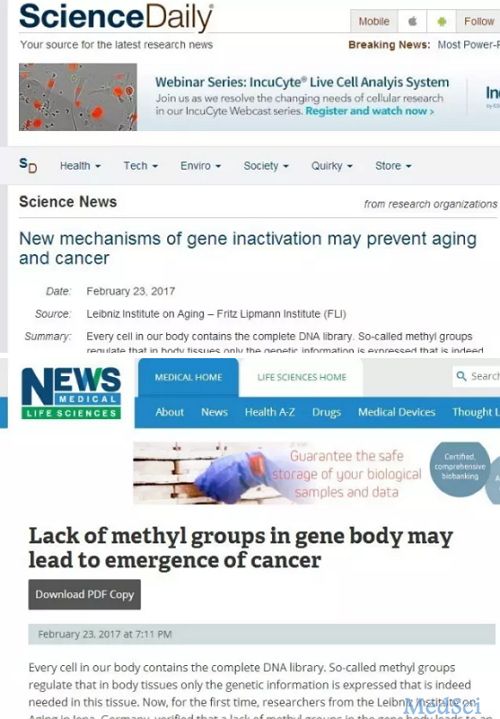
3月1日,笔者正好在撰写有关表观遗传学的简介,在写到有关DNA甲基化功能介绍这块时,一不小心不知怎么发现一篇正好与此相关的新闻报道,题为《基因甲基化缺失是致癌重要成因,将为治疗癌症提供新途径》(来源为《科技日报》,《澎湃新闻》做了转载),点开一看发现是前天发布的,然后笔者详细的阅读了该报道,读完后觉得这个内容好像有些夸大的成分。

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#Nat#
37