全新临床失败、加速评估被撤、用药被限制 诺华近期有点背!
2019-07-31 佚名 新浪医药新闻
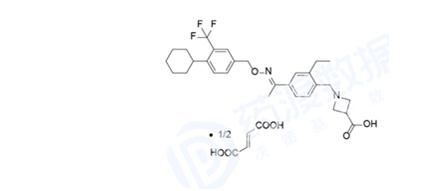
诺华重磅心衰药物Entresto已被批准用于治疗射血分数降低的心力衰竭(HFrEF),该公司一直在努力希望扩大适应症,用于治疗另一种类型的心力衰竭——射血分数保留的心力衰竭(HFpEF)。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#诺华#
39