2019 ASCO:小分子药物新近进展
2019-06-25 不详 网络
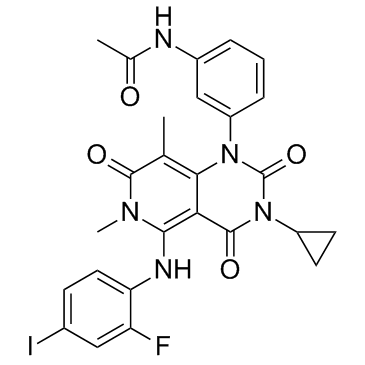
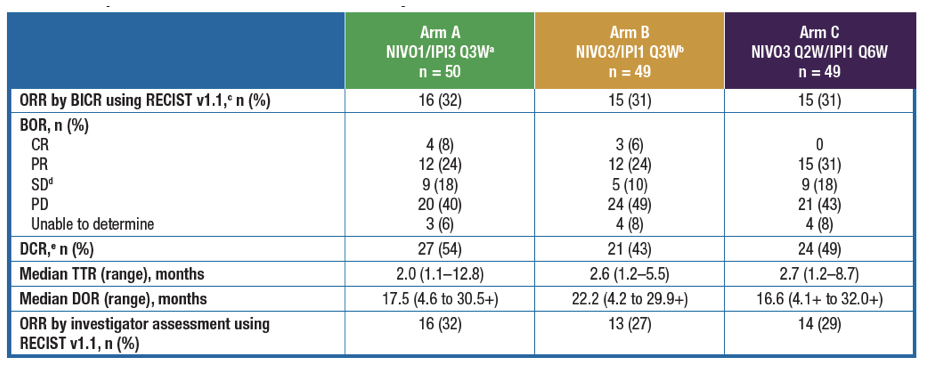
小分子药物,特别是小分子靶向药,在肿瘤治疗中占有不可或缺的一席之地。通过靶向不同的肿瘤信号通路,可以特异地抑制肿瘤的生长、转移和复发。大多数小分子药物可通过口服吸收,并能靶向膜蛋白和胞内蛋白,这是生物大分子很难达到的。虽然生物大分子药以势不可挡的速度突飞猛进,但小分子药物的发展依然不可小觑。特别是近年来针对某些靶点的广谱抗癌药物,给一些难治性患者带来了希望。今年美国临床肿瘤学会(ASCO)有数
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#小分子#
42
#ASC#
36