Nature:Ras研究的复兴
2015-05-07 红枫 中国科学报
研究者开展了长达30年的不懈探索,但最终仍然未能开发出一种药物来对付一类最致命的致癌性蛋白家族。如今,一些研究者摩拳擦掌,准备再次大显身手。 当Stephen Fesik离开制药行业,转而投身于学术型药物研发实验室的建设时,他列出了五种最重要的、被科学界广为知晓的致癌性蛋白质。这些蛋白质能够促进肿瘤的生长,但是大量事实证明,它们是药物开发商们的梦魇:它们的表面过于平滑,结构过于松
研究者开展了长达30年的不懈探索,但最终仍然未能开发出一种药物来对付一类最致命的致癌性蛋白家族。如今,一些研究者摩拳擦掌,准备再次大显身手。
当Stephen Fesik离开制药行业,转而投身于学术型药物研发实验室的建设时,他列出了五种最重要的、被科学界广为知晓的致癌性蛋白质。这些蛋白质能够促进肿瘤的生长,但是大量事实证明,它们是药物开发商们的梦魇:它们的表面过于平滑,结构过于松散或者复杂,因此一般的药物难以与其结合并阻断其致癌作用。在药物研发领域中,这些蛋白质被称为“无法用药物靶向”的蛋白质。
Fesik所列出来的、最重要的“罪魁祸首”之一是Ras蛋白家族。30多年以来,人们一直都知道Ras蛋白编码基因上的突变是最强有力的癌症驱动因子之一。研究者们已经在一些具有强侵袭性和致死性的癌症中发现了Ras突变的存在,包括25%的肺癌和90%左右的胰腺癌。而对于某些类型的晚期癌症而言,携带Ras突变的患者会在病程的较早阶段死亡,而未携带突变的患者的死亡时间则较晚。
研究者们虽然对Ras进行了长达数十年的研究,但是仍然未能开发出一种能够安全抑制Ras活性的药物。曾经的失败促使研究者们不再从事该领域的研究,也迫使制药公司放弃已经提出的研发计划。但是范德堡大学(Vanderbilt University,位于田纳西州纳什维尔市)的Fesik实验室以及其他少数几支研究团队仍然将自己的研究重点重新聚集在Ras蛋白上。他们拥有改良的研究技术,并且深入了解了Ras蛋白的作用机制。美国国家癌症研究所(National Cancer Institute)在去年启动了Ras项目(Ras Initiative),每年将在该项目上耗资1000万美元,以寻找新方法来应对由Ras引发的癌症。研究者们正在寻找一些特殊的化合物,这些化合物在经过调整以后,最终可被研发成第一种以Ras蛋白为靶标的药物。
研究者们知道,他们仍然需要跨越众多障碍才能够获得成功。总部位于加利福尼亚州拉荷亚的Wellspring Biosciences公司成立于2012年,它将目标锁定在Ras靶向性药物的研发上。该公司的总裁Troy Wilson表示,必须非常重视Ras,不能够低估它的功能。它是肿瘤发病过程中最重要的致癌基因之一。
支持重新研究Ras的拥护者们指出,任何成功的迹象都可以为我们提供借鉴,知道该如何靶向于其他重要的、被认为“无法用药物靶向”的蛋白质。北卡罗来纳大学教堂山分校(University of North Carolina at Chapel Hill)的癌症研究者Channing Der指出,人们只是想当然地认为Ras蛋白难以靶向,但是这并不代表科学家就应当放弃对Ras的研究。“教条主义才是我们应当克服的活动靶标。”
可望而不可及的研究对象
Der研究团队在1982年时首次指出,Ras蛋白编码基因上的突变可以导致人类发生肿瘤。当时,研究者们正在纷纷寻找人类基因组中的致癌基因(oncogenes)——即能促进肿瘤发生的基因,而Der等人的发现则标志着致癌基因的研究热潮达到了顶峰。研究者们之前只在病毒和动物模型中研究过Ras蛋白编码基因的突变。
这一发现为现代癌症研究的主要方向奠定了基础:它强调指出,研究者们需要追踪基因突变,并找到发生改变的分子通路。它也点燃了人们的希望,使人们以为能够找到致癌基因靶向性药物,治愈某些类型的肿瘤。
研究者们在接下来的几年里硕果累累。人们越来越清楚地认识到:人类可以产生三种高度相似的Ras蛋白,当细胞需要进行增殖时(例如,为了取代受损的组织时),这些Ras蛋白就会被激活。Ras蛋白在细胞外信号的刺激下处于“开启”的状态,随后就能与一种名为GTP的分子相结合。而致癌性Ras蛋白则无法被“关闭”,也无法正确地处理GTP。因此一种看似合乎常理的做法是:寻找能够干扰GTP结合的药物,以阻断突变型Ras的致癌作用。
但是随着人们越来越深入地了解了Ras的生物化学过程,越来越多的研究者们对Ras研究产生了悲观的情绪。研究者们最终证明,Ras蛋白家族对GTP的亲和力非常高,因此我们似乎不可能找到第二种可以阻断GTP结合的化合物。Ras蛋白也可以与其它蛋白质相互作用,促进癌症的发生,但是蛋白质-蛋白质交互作用一般都发生在细胞表面上,而能进入细胞内部的小分子药物往往都太小了,无法“封锁”宽阔的细胞表面。(抗体是疗效极好的药物,因为它们能够“封锁”靶细胞较大的表面区域,但是大多数抗体都无法穿透细胞膜。)
Ras蛋白的结构由于种种原因而引起了人们的担忧。药物开发商们通过观察蛋白质的形状,往往就能够估计出他们有多大的可能性能够找到可与蛋白质关键部位结合的化合物。他们希望能够看到一个拥有深口袋结构的蛋白质,因为药物就能够滑入蛋白质的深口袋结构中,并且与多个接触点相结合,从而发挥药效。然而,Ras蛋白的表面比较平滑。
研究者们早在二十年前就以为他们已经成功地解决了这一问题。Ras蛋白为了发挥自身的生物学功能,往往需要利用一个脂肪酸尾巴来紧紧抓住细胞膜的内侧。而这一条尾巴是由法尼基转移酶(farnesyl transferase)添加上去的;与Ras蛋白相比,法尼基转移酶更适合成为药物的靶标。 因此人们冒出了一个想法:通过寻找一些能够抑制法尼基转移酶的药物,从而来抑制Ras的活性。
起初,这种想法看起来是一个成功的治疗策略。法尼基转移酶抑制剂的确能够抑制小鼠细胞和人类癌细胞的增殖。在21世纪早期,至少有六家制药公司都竞相地把这类药物推向市场。马克斯·普朗克分子生理学研究所(Max Planck Institute of Molecular Physiology,位于德国多特蒙得)的化学家Herbert Waldmann指出,有很多制药公司放弃了其他的Ras研究项目,因为他们认为Ras的问题已经得到了解决。他表示,整个制药行业都深吸了一口气,静静地等待着奇迹的发生。
然而,制药行业的等待却以失败而终结,而这次失败也成为药学史上最令人失望的时刻之一。法尼基转移酶抑制剂在人体临床试验中一个接一个地失败了。当时仍然在从事Ras研究的Der指出,这件事情教会了他和其他所有人有关Ras生物学机制的重要一课。
三种类型的人类Ras蛋白具有近乎相同的分子结构和氨基酸序列。研究者们想当然地认为它们的功能也是相同的。大多数Ras蛋白研究工具(包括培养细胞、转基因小鼠和抗体)都是以H-Ras为模板研发出来的,因为与其他类型的Ras蛋白相比,研究者们能够更轻松地对H-Ras进行试验。Der指出,包括他在内的所有人都认为,既然我们只需要全面了解H-Ras就可以获得成功,那何苦还要去研究其它两种Ras蛋白呢?不幸的是,他们在这个错误的观念上耗费了大量的经费。
事实证明,另外两种类型的人类Ras蛋白(K-Ras和N-Ras)在肿瘤发病过程中其实发挥了更重要的作用,而且细胞自身也有一套适当的应急措施来维持正常的运转。当细胞缺少法尼基尾巴时,另一种酶就能够往Ras蛋白上添加一条不同的脂肪酸尾巴,从而使得实验性药物发挥不了任何的治疗效果。
法尼基转移酶抑制剂的失败重创了Ras研究领域;事情过了很久以后,研究者们才愿意重新研究Ras蛋白。但是大约十年以后,Ras研究热潮又开始卷土重来。Waldmann指出,突然之间人们都转过身说:“嘿,Ras在肿瘤发病过程中仍然是最重要的靶标之一呢。十年以来都没有人在Ras研究领域做出过成果。我们来研究一下吧。”这一次,研究者们采取了一种新的研究方法:在Ras引起的肿瘤上寻找其弱点。
这些肿瘤的其中一个弱点是“合成致死(synthetic lethality)”。当Ras蛋白处于超负荷工作状态下时,肿瘤细胞为了生存下来,通常都会依赖于其它的分子通路。如果阻断这些分子通路,可能并不会影响正常细胞的功能,但是却能够杀死由Ras引起的肿瘤细胞。于是众多实验室纷纷开始筛查工作,看看有哪些基因能够与突变型Ras编码基因联合起来引起合成致死;他们认为,通过靶向于这些基因,就可以杀死肿瘤细胞,而不会影响正常细胞的功能。
结果,研究者们发表了大批文章,报告了一系列可能的新靶点。随后他们又发表了大批文章,指出合成致死的研究结果是无法被重现的。瑞士诺华(Novartis)制药公司的肿瘤学全球总监(Global Head of Oncology)William Sellers在去年十月份的一次会议上报告称,他的研究团队曾经尝试着去重现已发表的、最重要的Ras合成致死研究结果,但是均以失败告终。伦敦弗郎西斯•科瑞克研究所(Francis Crick Institute)的癌症研究者Julian Downward指出,Ras合成致死实验的结果很容易随着实验条件(例如所使用的细胞类型或特定的筛选条件)的改变而发生改变。研究者们仍然在仔细筛选研究结果,以期找到能阻断Ras致癌作用的靶点,但是Downward却怀疑他们的努力能否结出果实。他表示,每个人似乎都从这些实验中找到了一些不同的联合基因。Downward怀疑这些基因都不会成为最有效的药物作用靶点。
根据Ras蛋白的结构来定制相匹配的化合物
合成致死的研究方法最终令人大失所望。一些研究者带着这种挥之不去的失望感,希望能够直接靶向于Ras蛋白(见“攻击Ras”)。哥伦比亚大学(Columbia University,位于美国纽约州)的生物化学家Brent Stockwell表示,他们下定决心,直接去研究Ras。
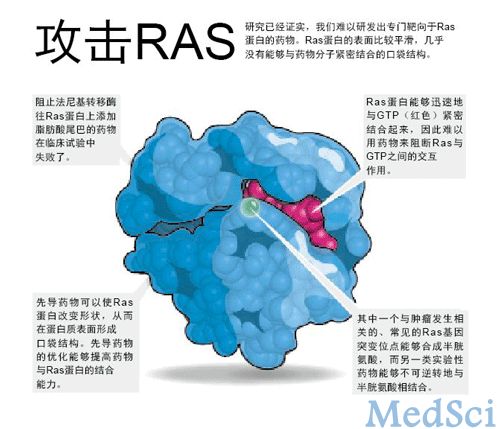
Stockwell指出,在过去的五年里,计算机建模技术和药物化合物的筛选方法得到了极大的改进,从而使得研究者们重新燃起了希望,有望去靶向于表面平滑的、无口袋结构的Ras蛋白质。研究者们如今能够更好地预测小分子物质与蛋白质之间的亲和力,也能够更好地了解蛋白质的动态变化。
Stockwell研究团队目前正在利用这些改进后的技术,根据Ras蛋白的表面结构专门设计出一些相匹配的小分子——首先在计算机上建模,随后在实验室中进行合成。Stockwell表示,对于这些蛋白质而言,你可能无法从世界上现有的化合物中找到正确的解决办法。你只能自己去创造解决办法。
Fesik也在创造新药物,但是他首先筛查了现有的化合物库。Fesik曾经就职于雅培公司(Abbott Laboratories,位于伊利诺斯州雅培科技园);当时他设计了一些特殊的方法来干扰蛋白质之间的交互作用:首先将可与靶标相结合的、但结合力较弱的化合物分解开来,然后将化学物的片段拼凑到一起。Fesik利用这种方法,合成了一个分子量较大的、在用于寻找药物的标准化合物库中都不太可能找得到的新化合物。
Fesik将这项名为药物片段筛选技术(fragment-based screening)比喻成配钥匙的过程:每次都往钥匙上刻一道凹槽,从而为锁专门配制一把钥匙。他指出,最后你就可以将所有的凹槽组合起来。从来没有人造出过这种化合物,但是你最终还是会找到它的,因为你正在逐步地构建这种化合物,使它能够与你感兴趣的蛋白质相匹配。
Fesik实验室及其制药行业的合作者们已经发现了130多种可与K-Ras蛋白微弱结合的分子。这些化合物能够引起K-Ras蛋白发生结构上的改变,并且在K-Ras蛋白结构变化的过程中打开一个结合口袋。Fesik研究团队目前正在尝试着往这些分子中添加其它的化合物片段,以改善其与Ras蛋白的匹配程度——实际上,这些化合物片段就相当于钥匙上的第二道凹槽。Der指出,Fesik在离开制药行业、开始追求学术生涯之前,早就已经闻名遐迩了,因为他为这些“无法用药物靶向”的Ras蛋白定制了靶向性药物。Der还指出,如果有人打算这样做的话,那一定是Fesik。
而其他研究者则选择利用K-Ras编码基因上特定的突变位点。尽管在K-Ras编码基因上有很多不同的、与肿瘤发生有关的突变位点,但是Ras所引起的绝大多数癌症都是由其中三个突变位点所诱发的。Der指出,每一个突变位点都能够产生一种生物学行为稍有差别的酶。他表示,如果我们开始认识到不同的突变位点具有不同的个性,那么这些不同的个性可能会向我们展示出Ras蛋白特有的脆弱点。
加利福尼亚大学旧金山分校(University of California,San Francisco)的生物化学家Kevan Shokat在六年前就加入到Ras突变位点的搜寻队伍中了。他在2013年时报道了一种可以靶向于G12C(K-Ras基因上的一个突变位点)的化合物。20%的肺癌患者都存在有G12C突变,这种突变能够将甘氨酸替换成半胱氨酸,而半胱氨酸极易与其它分子反应。Shokat所研发的化合物能够不可逆转地与这种活性较高的半胱氨酸相结合。Downward指出,我们还需要再继续调整这种抑制剂的结构,才能够用它来治疗癌症患者,但是作为首个能直接与Ras蛋白结合的候选药物,它已经使制药行业的从业人员们欣喜若狂。Downward表示,它让整个制药行业重新恢复了活力。
Shokat指出,他一直都认为特定突变位点的靶向方法可能会奏效,但是直到最近他才打消顾虑,在自己的实验室中验证这一方法的效果。他指出,药物开发商们很害怕研发出一些能紧紧抓住其靶标不放的药物,因为这些药物似乎更有可能与机体内的其它蛋白质发生难以预料的反应。但是最近有研究发现,一些成功的药物,例如淋巴瘤和骨髓瘤的治疗药物依鲁替尼(ibrutinib)能够不可逆转地与其靶标相结合。
与此同时,制药公司越来越接受这样一种药物研发理念:针对携带特定基因突变的肿瘤患者,来研发有效的个性化治疗药物。匹兹堡大学(University of Pittsburgh,位于宾夕法尼亚州)的癌症研究者Timothy Burns预测:没有一种药物能够有效地治疗所有的K-Ras患者。
Fesik指出,学术研究机构可能会找到Ras谜题的解答方案。他从制药行业中抽离出了部分精力,主要是因为他很喜欢去探寻重要的治疗靶点,不论这一探寻过程有多么的容易或艰难。制药行业的研究者们难以找到充分的理由去探寻一种无法用药物靶向的蛋白质,因为制药公司往往会优先考虑近期内获得利润的可能性,其次才会考虑研究的科学价值。他表示,大多数制药公司都不愿意冒险去研究这些无法用药物靶向的靶标,即便他们进行了研究,也只是暂时性的。
然而,公司利润和科学价值之间正在形成桥梁。Fesik实验室已经与德国勃林格殷格翰(Boehringer Ingelheim)制药公司合作,共同评价第一代Ras结合药物的治疗效果。而Shokat则与其他人合伙创建了Wellspring Biosciences公司,以便将自己研发的抑制剂推向市场。他的工作很快就获得了杨森生物科技集团(Janssen Biotech,位于宾夕法尼亚州霍舍姆)的支持。
制药行业的一系列努力也引起了政府部门的关注。加利福尼亚大学旧金山分校的癌症研究者Frank McCormick是Ras项目的联执主任,他指出,Ras项目每年所获得的几百万美元的资助,将会被用来全面支持Ras研究工具的开发及Ras蛋白结构的基础研究,以便推动Ras靶向性药物的研发。他们正在试图减少以Ras蛋白为靶标的研究风险,如此一来,其他研究者就可以跳回到擂台上,再次全力一搏。
McCormick指出,制药行业多年以来一直都在研究另一类名为激酶(kinase)的蛋白质,因为他们能够很轻松地从这类蛋白的研究中获得成果。激酶容易被化合物靶向,并且可以研发出多种有效的肿瘤治疗药物。但是McCormick认为,激酶的研究热潮开始慢慢消退,现在应该去关注一些可望而不可及的研究对象了:即一些较难靶向的、但至关重要的治疗靶标(例如Ras蛋白)。
Stockwell指出,他希望Ras蛋白研究的复兴能够激励那些研究其它棘手的药物靶标的科学家们。他认为,如果研究者们在Ras蛋白的研究中获得一些成功的话,可能也会激励他们去研究其他的靶标。“如果我们真的想要影响癌症发病的话,那么我们还需要去研究其他尚未被挖掘的大量靶标。” Stockwell说到。(原文题目:向着终极致癌蛋白开炮-RAS蛋白研究复兴开辟癌症治疗新战场)
原始出处:
Ledford H. Cancer: The Ras renaissance.Nature. 2015 Apr 16;520(7547):278-80
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Nat#
32