PNAS:美开发新疗法 有望战胜7种癌症
2012-04-10 新华网 新华网
日前,美国科学家研制出了一种能帮助人体免疫系统摧毁癌细胞的新型药物,对乳腺癌、肠癌、前列腺癌、子宫癌、脑癌、膀胱癌、肝癌等多种癌症都有疗效。此外前期研究表明,该药物还可用于治疗血癌(白血病)。研究人员表示,若能及早使用,该药物甚至可以完全治愈恶性肿瘤疾病,且副作用极小。 目前这种药物仅在小白鼠身上进行了试验,研究人员希望能在两年内开始临床试验。 据悉,新型药物的效力集中于一种大量存在于癌细胞表

日前,美国科学家研制出了一种能帮助人体免疫系统摧毁癌细胞的新型药物,对乳腺癌、肠癌、前列腺癌、子宫癌、脑癌、膀胱癌、肝癌等多种癌症都有疗效。此外前期研究表明,该药物还可用于治疗血癌(白血病)。研究人员表示,若能及早使用,该药物甚至可以完全治愈恶性肿瘤疾病,且副作用极小。
目前这种药物仅在小白鼠身上进行了试验,研究人员希望能在两年内开始临床试验。
据悉,新型药物的效力集中于一种大量存在于癌细胞表面的蛋白质,这种名叫“CD47”的蛋白质能使癌细胞免于被叫作“巨噬细胞”的免疫细胞所吞噬。新药物能去掉癌细胞这一“不要吞噬我信号”,让免疫系统直接对恶性肿瘤细胞展开攻击。
该药物研究员,美国斯坦福大学医学院博士欧文·韦斯曼表示:“没了‘不要吞噬我信号’,小白鼠体内的几乎所有种类的人类癌细胞都不再增长,且(新药物)副作用极小。我们的研究表明,‘CD47’确为人类战胜癌症的关键。”
韦斯曼博士补充称,当新药物作用于小型肿瘤时“有治愈的可能”,但在某些小白鼠身上,却没有丝毫疗效。即便如此韦斯曼博士还是认为,新药物现已具备临床试验的条件,需“快速而慎重地推进”。
对于新药物安全性的严格要求意味着该药物的广泛应用可能还需十几年的时间,英国癌症研究会免疫学专家菲利普·阿什顿·利卡特教授认为,上述研究可能会创造全新的癌症疗法。“对传统化疗或放射性治疗已产生抵抗力的恶性肿瘤细胞将有可能通过这种新药物得到控制,但新药物还需在临床试验中证明其在人体内的效果。”(生物谷Bioon.com)

doi:10.1073/pnas.1121623109
PMC:
PMID:
The CD47-signal regulatory protein alpha (SIRPa) interaction is a therapeutic target for human solid tumors
Stephen B. Willingham, Jens-Peter Volkmer, Andrew J. Gentles, Irving L. Weissman et al.
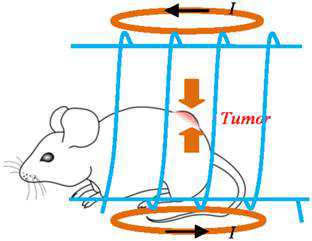
CD47, a “don't eat me” signal for phagocytic cells, is expressed on the surface of all human solid tumor cells. Analysis of patient tumor and matched adjacent normal (nontumor) tissue revealed that CD47 is overexpressed on cancer cells. CD47 mRNA expression levels correlated with a decreased probability of survival for multiple types of cancer. CD47 is a ligand for SIRPα, a protein expressed on macrophages and dendritic cells. In vitro, blockade of CD47 signaling using targeted monoclonal antibodies enabled macrophage phagocytosis of tumor cells that were otherwise protected. Administration of anti-CD47 antibodies inhibited tumor growth in orthotopic immunodeficient mouse xenotransplantation models established with patient tumor cells and increased the survival of the mice over time. Anti-CD47 antibody therapy initiated on larger tumors inhibited tumor growth and prevented or treated metastasis, but initiation of the therapy on smaller tumors was potentially curative. The safety and efficacy of targeting CD47 was further tested and validated in immune competent hosts using an orthotopic mouse breast cancer model. These results suggest all human solid tumor cells require CD47 expression to suppress phagocytic innate immune surveillance and elimination. These data, taken together with similar findings with other human neoplasms, show that CD47 is a commonly expressed molecule on all cancers, its function to block phagocytosis is known, and blockade of its function leads to tumor cell phagocytosis and elimination. CD47 is therefore a validated target for cancer therapies.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#PNAS#
0
#新疗法#
34