FDA 指导文件:使用真实世界数据和真实世界证据向 FDA 提交药品和生物制品文件
为了便于 FDA 对提交给 FDA 的包括真实世界数据 (RWD) 和真实世界证据 (RWE) 的提交进行内部跟踪,本指南鼓励申办者和申请人在提交的求职信中指明 RWD/RWE 的某些用途。本指南不涉
FDA - 真实世界证据,真实世界数据 - 2022-09-10
梅斯医访谈 | FDA真实世界证据框架
梅斯医访谈(MedSci Interview, MSI)致力于分享医学专业知识,传播医学前沿观念。
MedSci原创 - FDA,真实世界研究 - 2018-12-12
美国FDA发布《真实世界证据方案框架》
美国FDA新框架:应用真实世界证据,支持药品审批决策2016年12月美国颁布《21世纪治疗法案》,要求FDA在医疗产品审批和监管程序中纳入真实世界证据(Real-World Evidence, RWE)此后FDA陆续发表声明、颁布指南,阐述RWE的定义和特点,规范RWE的产生和应用,并将充分发挥RWE在审批监管决策中的作用视作其首要战略重点。2018年12月6日,FDA重磅宣布《真实世界证据
协和结核 - FDA,真实世界,临床研究 - 2018-12-09
美国FDA意将真实世界研究取代传统临床试验
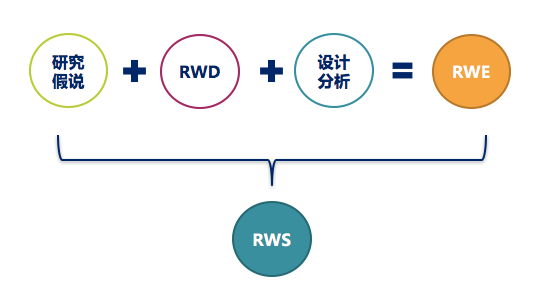
有专家称,真实世界研究(Real-World Study,以下简称RWS)将是未来研究的趋势,相对随机对照试验(Randomized Controlled Trial,以下简称RCT)而言,RWS的研究范围更广,更具有代表性,能够真实地反映研究的情况。
MedSci原创 - 真实世界研究,临床试验 - 2017-01-12
三位FDA前任局长共同呼吁:扩展真实世界证据的应用
近日,三位FDA前任局长在联合署名的一份报告中,呼吁扩展真实世界证据(real world evidence,RWE)在监管与支付决策中的应用。
药明康德 - 真是世界证据,临床研究,药物审批 - 2019-09-25
真实世界研究之真实之路:特点与难点
真实世界研究(Real-world Study, RWS)是从1992年正式提出循证的概念,至现在超过20年,深刻影响医学临床实践与医学研究。真实世界研究起源于实用性临床试验,最早应用于药物流行病学范围。指在较大的样本量(覆盖具有代表性的更广大受试人群)的基础上,在真实医疗过程中,根据患者的实际病情和意愿非随机选择治疗措施,开展长期评价,并注重有意义的结局治疗,在广泛真实医疗过程中评价干预措施
MedSci原创 - 真实世界研究,梅斯医学 - 2017-09-01
用于产生真实世界证据的真实世界数据指导原则(征求意见稿)
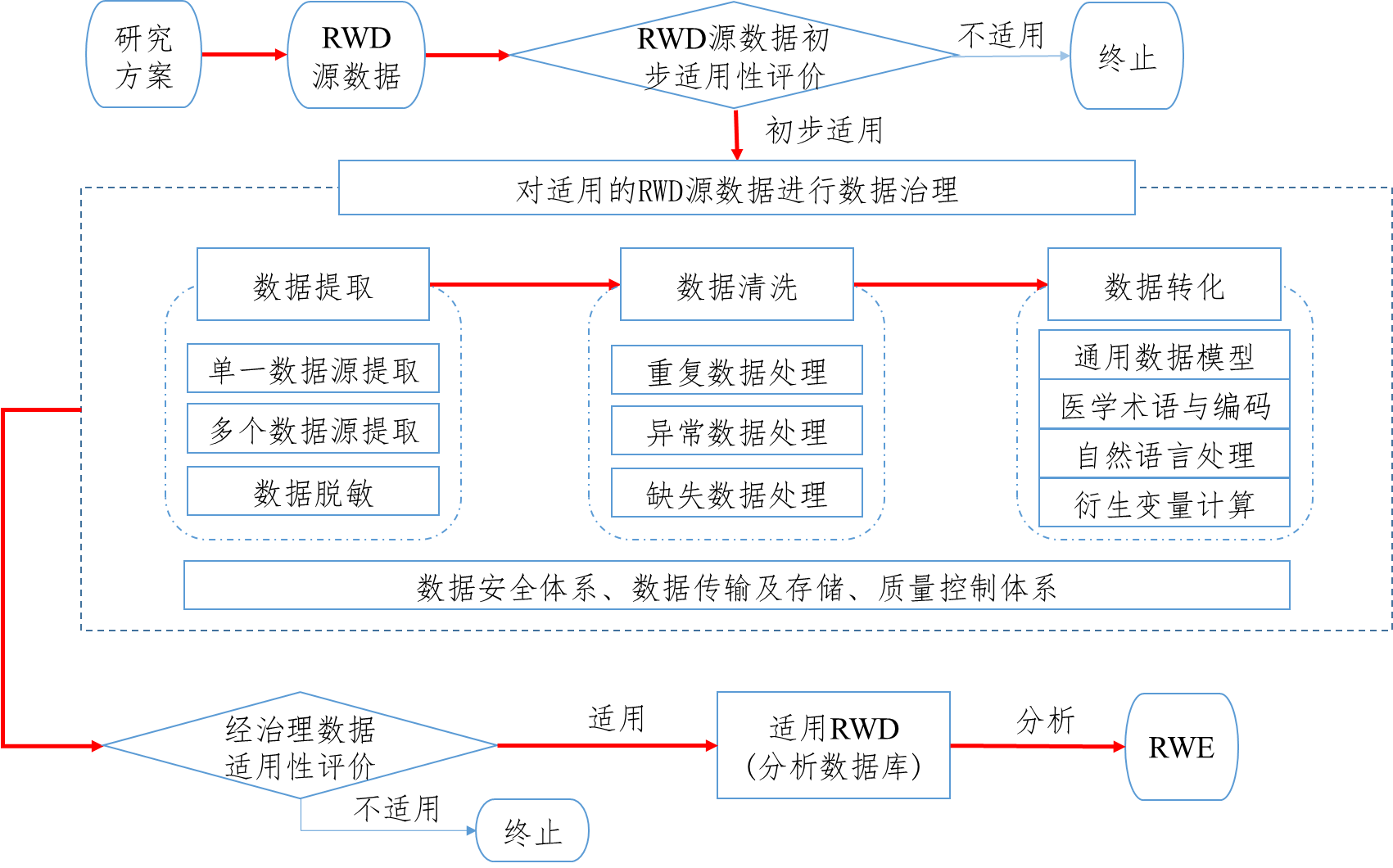
为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,我中心组织起草了《用于产生真实世界证据的真实世界数据指导原则(征求意见稿)》,现在中心网站予以公示,以广泛听取各界意见和建议,欢迎
CDE - 真实世界证据,真实世界研究 - 2020-08-03
NEJM:真实世界证据,路在何方?
距离2016年通过《21世纪治愈法案》(21st Century Cures Act)已过去5年多,“真实世界数据”(RWD)和“真实世界证据”(RWE
NEJM医学前沿 - 真实世界证据,真实世界数据 - 2022-05-09
FDA行业指南:使用真实世界数据和真实世界证据向 FDA 提交文件以获取药物和生物制品审批
本指南旨在鼓励使用真实世界数据 (RWD) 的申办者和申请人生成真实世界证据 (RWE),作为向 FDA 提交监管文件的一部分,以简单、统一的格式提供有关其使用 RWE 的信息 . FDA 将仅将这些
FDA - 真实世界,真实世界数据 - 2021-10-24
FDA:CVM GFI #266 使用真实世界数据和真实世界证据来支持新动物药物的有效性
本指南描述了 CVM 打算如何评估提交给 CVM 的真实世界数据和真实世界证据,以证明新动物药物申请的有效性的实质性证据或新动物药物有条件批准申请的有效性的合理预期。 它还提供有关申办者如何在提交申请
FDA - 真实世界数据 - 2021-10-24
《用于产生真实世界证据的真实世界数据指导原则(试行)》
为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,药审中心组织制定了《用于产生真实世界证据的真实世界数据指导原则(试行)》(见附件)。根据《国家药监局综合司关于印发药品
国家药品监督管理局药品审评中心 - 真实世界数据,真实世界研究 - 2021-04-15
FDA指导原则:使用真实世界的证据支持医疗器械的监管决策
FDA 发布本指南以阐明我们如何评估真实世界数据,以确定它们是否足以生成可用于 FDA 医疗器械监管决策的真实世界证据类型。 本指南适用于所有设备,因为该术语是根据《联邦食品、药品和化妆品法案》(FD
FDA - 医疗器械 - 2021-10-22
用于产生真实世界证据的真实世界数据指导原则(征求意见稿)
为进一步指导和规范申办者利用真实世界数据生成真实世界证据支持药物研发,我中心组织起草了《用于产生真实世界证据的真实世界数据指导原则(征求意见稿)》,现在中心网站予以公示,以广泛听取各界意见和建议,欢迎
CDE - 指导原则 - 2020-09-01
FDA指导原则:包含真实世界数据的药品和生物制品提交数据标准
《21 世纪治愈法案》于 2016 年 12 月 13 日签署成为法律,旨在加速医疗产品开发,并更快、更有效地为有需要的患者带来创新。 除其他规定外,《21 世纪治愈法案》在《联邦食品、药品和化妆品法
FDA - 真实世界,真实世界数据 - 2021-10-24
为您找到相关结果约500个