人类细胞,组织,细胞组织产品的同源使用【英文版】
在21 CFR 1271.3(d)中HCT/Ps的定义是,包括或由人类细胞或组织构成的物质,这些细胞或组织用于植入,移植,融合或者转给受试者。FDA已经实施了一种基于风险的方法来监控HCT/Ps。在P
E18和M3(R2)及问答(R2)指导原则转化实施建议
为做好ICH指导原则转化实施工作,我中心在充分征求工业界意见的基础上,研究制定了ICH《E18:基因组采样和基因组数据管理指导原则》和《M3(R2)及问答(R2):支持药物进行临床试验和上市的非临床安
M7(R2)附录:ICH M7原则在化合物可接受摄入量计算中的应用【英文版】
ICH M7 指导原则(第 7.2.1 节)讨论了具有阳性致癌性数据的致突变杂质的可接受摄入量(AIs)的推导,并指出应采用该化合物的风险评估数据来推导其可接受摄入量。
M7(R2)附录:ICH M7原则在化合物可接受摄入量计算中的应用【中文版】
ICH M7 指导原则(第 7.2.1 节)讨论了具有阳性致癌性数据的致突变杂质的可接受摄入量(AIs)的推导,并指出采用该化合物的风险评估数据来推导其可接受摄入量。
CGP论著 | 2005—2021 年我国卫生人力资源发展趋势及公平性分析
对 2005—2021 年全国 31 省(自治区、直辖市)12 类医疗卫生机构、5 类卫生人力资源进行趋势描述和公平性分析,为未来各卫生机构人力资源配置优化提供参考。
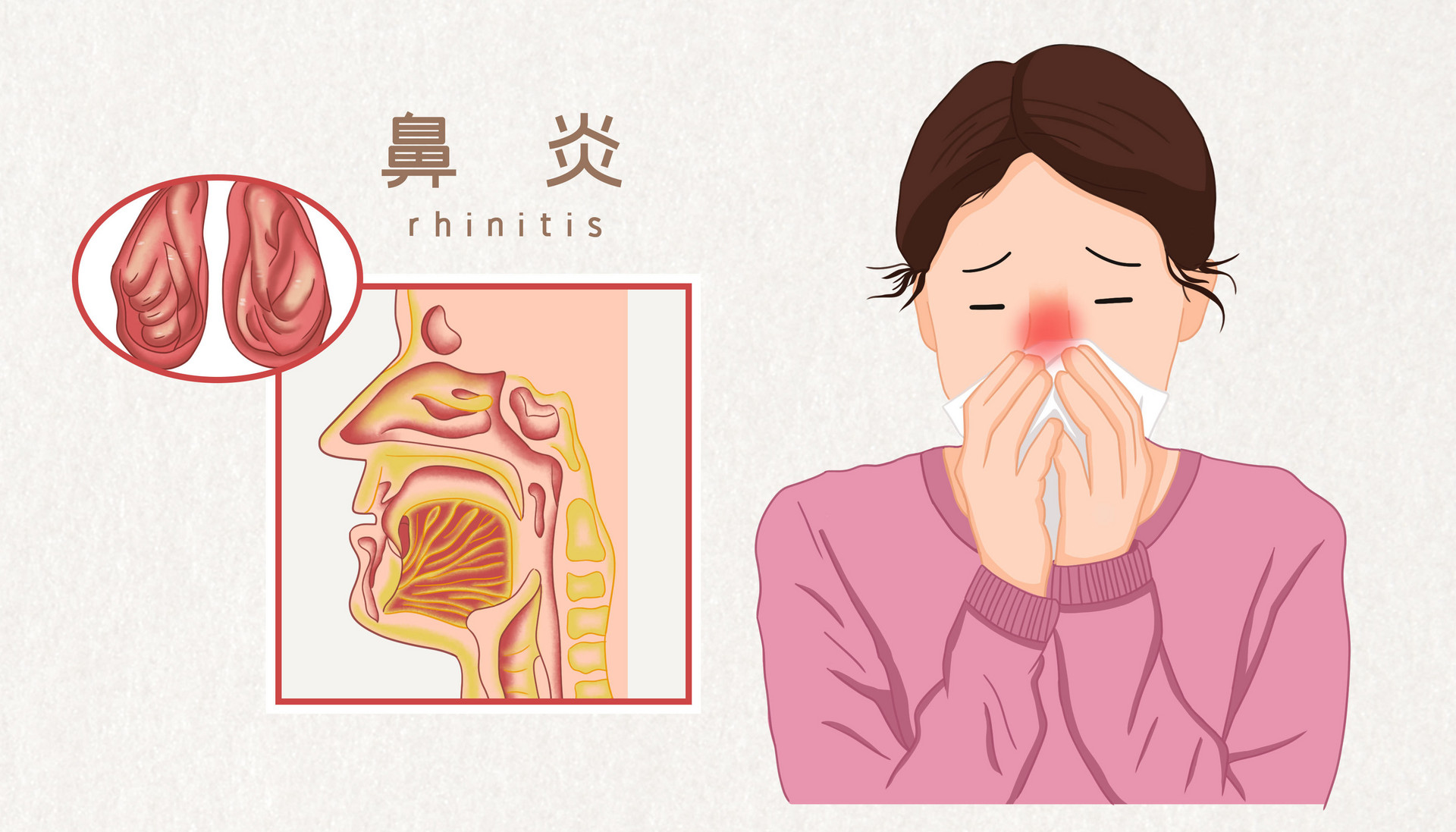
过敏性鼻炎治疗药物的研发【中文版】
本指南旨在帮助申办方研发治疗儿童和成人过敏性鼻炎治疗药物。指南内容包括在研发治疗季节性过敏性鼻炎(SAR)和常年性过敏性鼻炎(PAR)中试验设计,有效性,新药安全性的有关事项,安全性的定义。
Nature:2023年度全球十大科学人物,人工智能ChatGPT入选
《自然》年度十大人物(Nature’s 10)每年从全球的重大科学事件中评选出十位人物,而今年还有一位非人类上榜——ChatGPT。2023年的科学界取得了一些非凡
FDA指南:直接面向消费者的处方药广告:在电视和广播形式的广告中以清晰、显眼和中立的方式呈现主要声明 最终规则问答
本指南旨在帮助小型实体理解并遵守最终规则“直接面向消费者的处方药广告:在电视和广播格式的广告中以清晰、醒目和中立的方式呈现主要声明”(CCN 最终规则)(88 FR 80958
过敏性鼻炎治疗药物的研发【英文版】
本指南旨在帮助申办方研发治疗儿童和成人过敏性鼻炎治疗药物。指南内容包括在研发治疗季节性过敏性鼻炎(SAR)和常年性过敏性鼻炎(PAR)中试验设计,有效性,新药安全性的有关事项,安全性的定义。