EMA 收到molnupiravir的上市许可申请
在COVID-19病例中使用molnupiravir旨在减轻医院的压力,从而降低患者出现更严重的疾病症状的风险。
MedSci原创 - Molnupiravir - 2021-11-29
国外上市急需药品可以直接在CDE申请上市,免做临床
8月8日,药品审评中心(CDE)发布了《关于征求境外已上市临床急需新药名单意见的通知》,其对近年来美国、欧盟或日本批准上市新药进行了梳理,遴选出了Alectinib Hydrochloride 等48个境外已上市临床急需新药名单,可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请。
生物探索整理自CDE - 急需药品,药品管理,CDE,境外 - 2018-08-09
国内首个CAR-T新药上市申请获受理!
复星医药投资的复星凯特生物科技有限公司宣布,国家药品监督管理局(NMPA)已正式受理公司CAR-T细胞治疗产品益基利仑赛注射液(拟定)的新药上市申请(NDA)。
“复星凯特”微信公众号 - CAR-T,复星凯特 - 2020-02-27
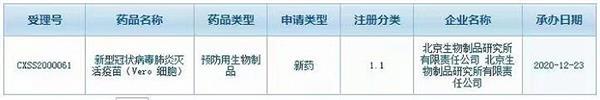
国药集团新冠疫苗国内上市申请获受理,有望在元旦前后上市
昨天,国家药监局药审中心( CDE )显示,国药集团北京生物制品研究所的新型冠状病毒肺炎灭活疫苗(Vero 细胞)上市申请已获CDE受理。据估计在元旦前后,CDE将会批准疫苗有条件上市。大家在元旦以后
网络 - 新冠疫苗 - 2020-12-24
首款TIL细胞治疗递交滚动上市申请
2022年8月25日,Iovance Biotherapeutics宣布启动递交TIL疗法lifileucel的滚动上市申请,用于治疗PD-1/PD-L1治疗后进展的晚期黑色素瘤,预计年底完成上市申请
医药笔记 - 细胞治疗,TIL - 2022-08-26
中国新锐公司再鼎医药 正式申请赴美上市
昨日,中国生物技术新锐再鼎医药(Zai Lab)正式申请赴美上市,并计划登陆纳斯达克市场(Nasdaq),募资1.15亿美元。消息一经确认,得到了业内的广泛关注。
药明康德 - 中国,新锐公司,再鼎医药,申请,赴美,上市 - 2017-08-18
Novo Nordisk提前长效胰岛素Tresiba的上市申请
丹麦制药巨头诺和诺德(Novo Nordisk)近日突然宣布,将在一个月内向FDA重新提交长效胰岛素Tresiba的上市申请,比之前预期的提前不少。
生物谷 - 长效胰岛素,申请上市 - 2015-03-30
FDA受理默沙东Remicade(类克)生物仿制药上市申请
美国制药巨头默沙东(Merck & Co)近日宣布,FDA已受理合作伙伴三星Bioepis(Samsung Bioepis)提交的生物仿制药SB2(infliximab,英夫利昔单抗)的生物制品许可申请
生物谷 - 生物仿制药 - 2016-05-25
AbbVie提交首个新药上市申请
2月25日,艾伯维/Allergan宣布已向美国FDA提交AGN-190584(1.25%毛果芸香碱滴眼液)的新药上市申请(NDA),用于治疗老花眼。FDA预计将在2021年底做出审批决定。
医药魔方 - 老花眼 - 2021-02-26
阿柏西普8 mg在中国上市申请被受理
阿柏西普用于治疗湿性年龄相关性黄斑变性的申请递交是基于PULSAR III期研究数据,中国监管机构目前正在审评研究数据。
拜耳 - 阿柏西普,视网膜疾病,新生血管性(湿性)年龄相关性黄斑变性 - 2024-01-25
里程碑:GSK向欧盟申请基因治疗上市
年5月5日,葛兰素史克公司(GlaxoSmithKline,GSK)正式向欧盟药监局(EMA)提交了ADA-SCID(腺苷脱氨酶缺陷所致重症联合免疫缺陷症)基因治疗方法(代号:GSK2696273)的上市申请
DrDaiyi - 基因治疗,GSK,上市 - 2015-05-13
强生向欧盟提交血癌药物Ibrutinib上市许可申请
强生(JNJ)旗下杨森(Jassen)10月30日宣布,已向欧洲药品管理局(EMA)提交了抗癌药物Ibrutinib的上市许可申请(MAA),寻求批准用于复发性或难治性慢性淋巴细胞白血病(CLL)/
生物谷 - 新药,FDA - 2013-11-01
葛兰素史克提交Albiglutide上市申请
葛兰素史克公司于2013年3月7日表示,已向欧洲药监部门提交了旗下每周注射一次的糖尿病新药Albiglutide的上市申请,力求能在竞争激烈的糖尿病药物市场占有一席之地。 葛兰素史克公司发言人表示, Albiglutid目前在全球范围内还没有获得上市批准。 分析人士指该产品可能会成为GLP-
丁香园 - 糖尿病,Albiglutide,GLP-1 - 2013-03-09
BI向EMA提交肺癌药物Nintedanib的上市许可申请
勃林格殷格翰已向欧洲药品管理局(EMA)提交了公司旗下口服三联血管激酶抑制剂Nintedanib的上市许可申请。
dxy - 肺癌药物 - 2013-10-16
为您找到相关结果约500个