两项瑞德西韦治疗新冠肺炎的临床试验启动,来看试验方案!
2020-02-11 龚志忠 医咖会
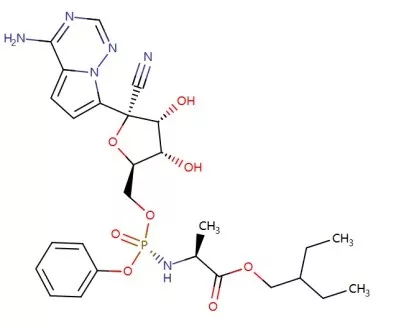
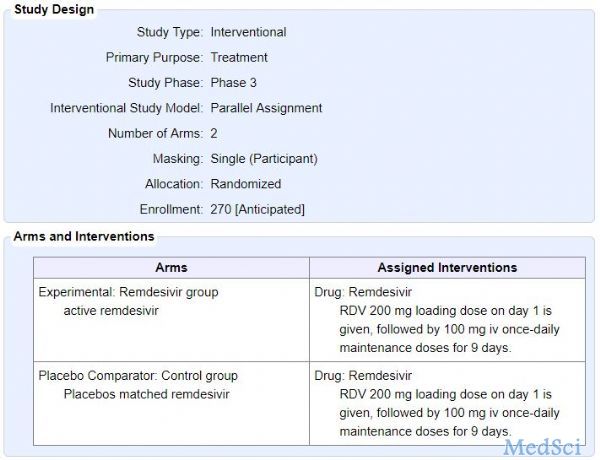
2020年1月31日,新英格兰医学杂志(NEJM)发表了一篇题为“First Case of 2019 Novel Coronavirus in the United States”的文章,介绍了美国首例确诊的新型冠状病毒(2019-nCoV)肺炎患者。医生在对该病人进行治疗的过程中,给予了尚未获批的药物Remdesivir(瑞德西韦,吉利德在研药物)进行试验性治疗,发现患者的病情迅速得到了控
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










新冠肺炎,疫情何时才能消失
52