线粒体替代疗法让他有了三位父母,但科学家还想走得更远
2022-11-28 生物探索 生物探索 发表于上海
结果表明,在强制线粒体自噬的情况下,77% 的人类囊胚中检测不到母体的线粒体DNA,平均线粒体异质性为0.09%。而对照组中均检测到了母体的线粒体DNA,平均线粒体异质性为3.89%。
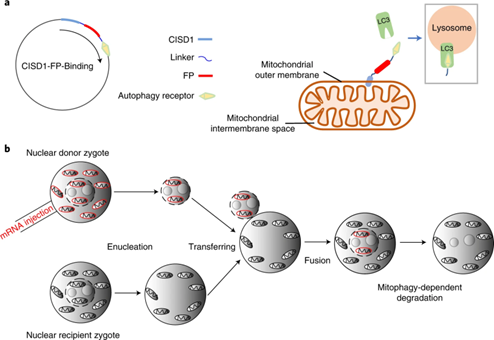
2016年4月6日,一名健康的男婴呱呱坠地。他的父母是约旦人,但他却是在墨西哥的医院在美国医疗团队的帮助下来到这个世界。更不同寻常的是,这名婴儿生物学意义上的父母,有三人。 这是因为孕育成这名男婴的受精卵,由父亲的精子,和一枚“复杂”的卵子受精而来,这枚卵子由捐赠者移除了细胞核的卵子以及从母亲卵子中取出的细胞核结合而成,也就是所谓的“第四代试管婴儿技术”。因此这名男婴遗传了来自父亲精子细胞核DNA,母亲卵子细胞核的DNA,以及捐赠者卵子中独立于细胞核的少量线粒体DNA。 近二十年来,这对约旦籍的夫妻一直在努力孕育下一代,但多次都以妻子流产告终。2005年,他们诞下一名女婴,但也就在这时他们发现了过去生育失败的原因:妻子1/4的线粒体携带有亚急性坏死性脑病的基因,虽然她本人健康,但女儿在出生时就患有Leigh综合征,该综合征会影响发育中婴儿的大脑、肌肉和神经。他们的女儿最终在六岁时去世,之后生下的第二个孩子也患有同样的疾病,只存活了8个月。 这对夫妇不得不来到纽约市新希望生育中心寻求华人医学博士张进(John Zhang)及其团队的帮助。张进一直对利用所谓“三亲”(three-parent)技术来避免线粒体疾病的方法有所研究。理论上讲,替代线粒体的疗法不止一种,有原核移植术、纺锤体核移植术以及极体移植术。 全球当时只有英国在2015年批准了合法实施原核转移术,这种方法首先分别让父亲和母亲、父亲和捐赠者的精卵结合,然后在两枚受精卵开始分裂前,取出母亲受精卵中的细胞核,取代捐赠者受精卵的细胞核。不过这种方法需要破坏两枚胚胎,很多国家认为受精卵已经具有了生命,在伦理上难以接受,这对穆斯林夫妻也是如此。因此张进将选择纺锤体核移植术,这种方法首先对捐赠者的卵子进行细胞核替换,然后再与父亲的精子结合成受精卵。 但两种方法都没有在美国获得批准。张进决定前往墨西哥,因为那里是“没有规则”的地方,他相信自己所做的是“合乎道德的事”。张进团队用该方法创造了5枚胚胎,其中只有一枚发育正常,被植入母亲体内。9个月后,孩子出生了,健康状况良好,跟其他小孩一样会哭、会笑、会闹。 张进和世界首例“三亲”婴儿(图源[1]) 同年10月19日,在美国生殖医学学会会议上张进团队宣布了这一消息。伴随着这名“三亲”婴儿曝光于世界的,还有巨大的争议。有人认为这是生殖医学开创性的一场手术,还有人认为这场手术未受监管,“不合伦理、不负责任”,还有人对安全性表示担忧。早在20世纪90年代,胚胎学家就在试图创造“三亲”婴儿解决线粒体遗传疾病,研究人员在27人身上进行了30次尝试,17名婴儿诞生,其中两个胎儿出现了遗传疾病,随后该技术被FDA叫停,出现问题的原因可能是因为胎儿的线粒体存在两个来源。 但张进团队对他们的“三亲”婴儿测量线粒体发现,各组织细胞线粒体携带致病突变的比例在2%至9%之间,而一般情况认为,超过18%的线粒体突变才可能引起问题。荷兰马斯特里赫特大学医学中心的Hubert J.M. Smeets则警告说,有缺陷的线粒体可能更善于复制,并将逐渐增加数量,张进团队应该监控孩子的线粒体确保突变携带保持在较低水平。 时隔三年,已逐渐被接受用于解决线粒体疾病遗传的“三亲”技术又首次被用于治疗不孕不育。2019年4月9日,一名体重2.9公斤的男婴成功降生。这次的母亲是一名32岁的希腊女性,并没有携带线粒体致病变异,但因卵子质量太差,4次试管婴儿手术均以失败告终。 牛津生育诊所医学主任Tim Child则对此事表示担忧,他说,线粒体转移带来的风险尚不清楚。小鼠实验表明,如果线粒体DNA与细胞核DNA不匹配,会加速小鼠衰老,并且影响新陈代谢和造成肥胖。如果该技术用于阻断线粒体疾病,风险或许还可以接受,但这次的母亲仅仅是因为不孕。 虽然“三亲”技术仍然存在争议,但并没有阻拦科学家进一步完善这项技术的决心。事实上,就像Hubert J.M. Smeets提醒的那样,核移植过程中致病线粒体DNA残留的问题尚未得到解决,而且因为选择性复制和遗传漂变,线粒体DNA可能会逐渐恢复到致病水平。 为此,广东省第二人民医院生殖医学中心粤港代谢与生殖联合实验室和青岛农业大学山东省高校动物生殖与种质创新重点实验室的研究团队通过诱导线粒体自噬的方法,减少了核移植过程中不必要的线粒体DNA残留。相关研究结果以“Reduction of mtDNA heteroplasmy in mitochondrial replacement therapy by inducing forced mitophagy”为题发表于Nature Biomedical Engineering(图2)[3]。 图2 研究成果(图源[3]) 在这项研究中,研究人员向母体卵细胞注射带有自噬受体和跨膜肽CISD1的mRNA。CISD1是一种信号锚定的跨膜肽,可以将自噬受体锚定在线粒体外膜外的细胞质中。自噬受体则负责募集自噬蛋白微管相关蛋白轻链3(light chain 3,LC3)),LC3与自噬受体结合后,将会与溶酶体融合降解线粒体。当待移植的细胞核被该mRNA标记后,这些不必要的线粒体DNA将会在移植后自行降解。研究人员称这种方法为“强制性线粒体自噬”。 图3 强制性线粒体自噬作用原理(图源[3])

结果表明,在强制线粒体自噬的情况下,77% 的人类囊胚中检测不到母体的线粒体DNA,平均线粒体异质性为0.09%。而对照组中均检测到了母体的线粒体DNA,平均线粒体异质性为3.89%。
从帮助携带线粒体DNA致病变异的母亲生育下一代,到改善高龄女性卵子质量不佳无法成功生育的情况,科学技术往往会走到伦理道德的前面,而人们对新技术的接受也非一朝一夕之事,能否在解决原有问题的同时,避免造成新的伤害和长远负面影响,学术界和公众都应心存敬畏。
参考资料:
[1]https://www.newscientist.com/article/2107219-exclusive-worlds-first-baby-born-with-new-3-parent-technique/.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






