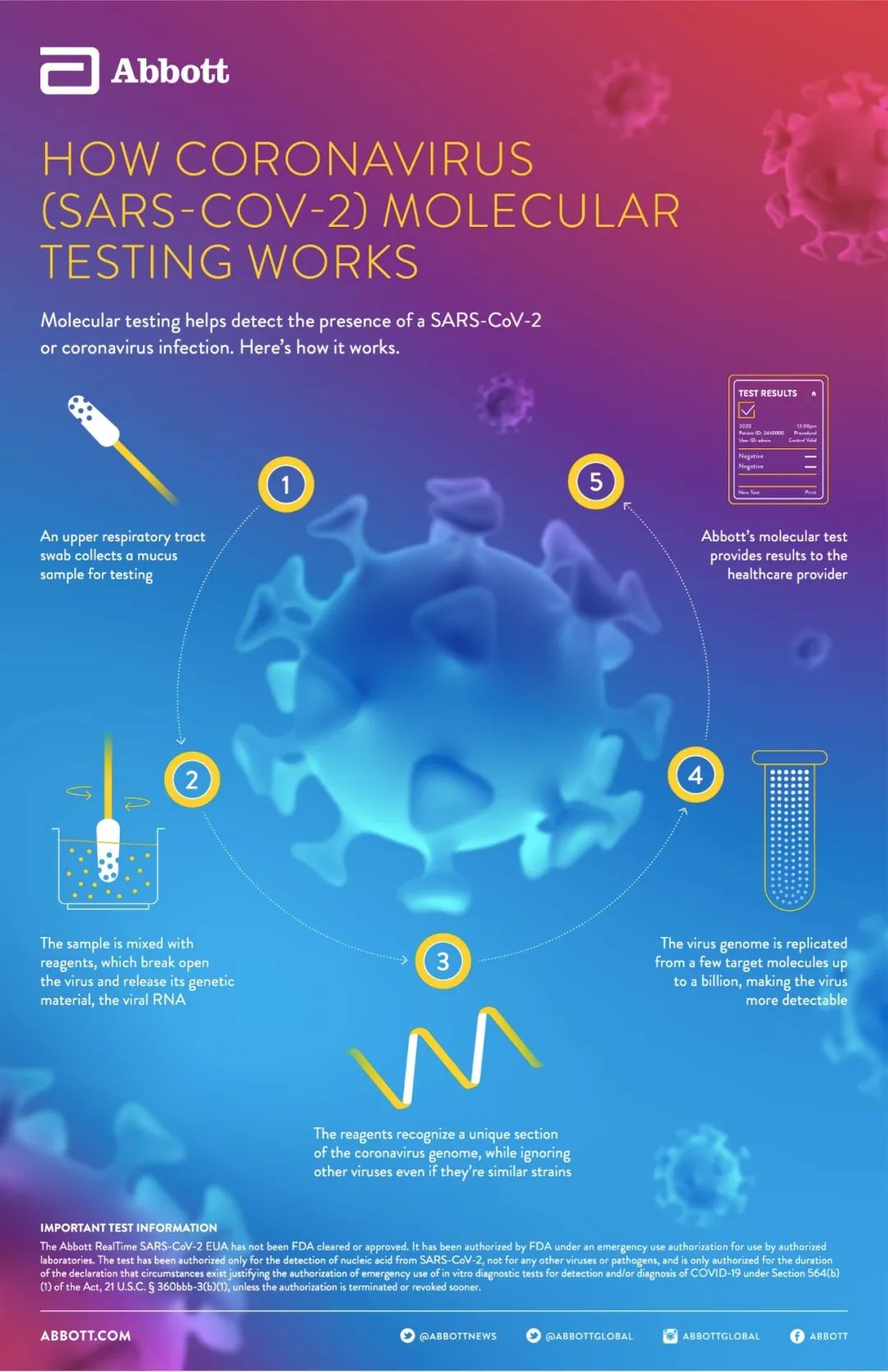
FDA:2020年一季度批准11款新药信息汇总
2020-04-04 MedSci MedSci原创
2020年第一季度,FDA共批准11个新药上市,其中1月份3个,2月份5个,3月有3个(此处所列新药,主要指FDA批准的新分子实体(NME)、新生物制品、细胞疗法、基因疗法,不包括疫苗)
2020年第一季度,FDA共批准11个新药上市,其中1月份3个,2月份5个,3月有3个(此处所列新药,主要指FDA批准的新分子实体(NME)、新生物制品、细胞疗法、基因疗法,不包括疫苗)
1. Ayvakit(Avapritinib)
1月9日,FDA批准Blueprint Medicines公司的Ayvakit (avapritinib)上市,用于治疗携带血小板源性生长因子受体 α(PDGFRA)基因18外显子突变的不可手术或转移性成人胃肠道间质瘤(GIST)患者,其中也包括D842V 位点突变这种最常见的18外显子跳跃突变类型。
Avapritinib是一种口服的、具有高活性高选择性的KIT及PDGFRα抑制剂。具有KIT及PDGFRα突变(包括KIT D816V、PDGFRα D842V 和KIT 外显子17突变)的多种疾病对标准疗法响应很差,缺乏有效的治疗方式,avapritinib针对以上突变在临床前均表现了很好的活性。
Ayvakit是第一个被批准用于GIST的精准疗法,也是唯一一个对PDGFRA基因18号外显子突变型GIST具有高活性的药物。分子机制是编码酪氨酸激酶受体蛋白基因 KIT(CD117) 或血小板源性生长因子受体 α(PDGFRα) 基因激活突变所致。GIST是一类起源于胃肠道间叶组织的肿瘤,占消化道间叶肿瘤的大部分。GIST 可以发生于消化道的任何部位,以胃和小肠最为常见,分子机制是编码酪氨酸激酶受体蛋白基因 KIT(CD117) 或血小板源性生长因子受体 α(PDGFRα) 基因激活突变所致。大约6%的新确诊患者携带PDGFA外显子18突变。
基石药业已与Blueprint Medicines达成独家合作及授权协议,获得了包括Ayvakit(avapritinib)在内的三款候选药物在中国大陆、香港、澳门及台湾的开发与商业化权利。Blueprint Medicines保留在世界其他地区开发及商业化这三款候选药物的权利。
2. Tepezza(Teprotumumab-Trbw)
1月21日,FDA批准Horizon Therapeutics的Tepezza(teprotumumab-trbw)上市,用于治疗甲状腺眼病。这是FDA批准的首个甲状腺眼病药物。
Horizon Therapeutics开发的teprotumumab在甲状腺眼病患者中的作用机制尚未完全阐明,能结合IGF-1R,阻断其介导的信号通路。Teprotumumab是一种靶向IGF-1R的单克隆抗体,III期OPTIC临床研究表明,治疗的24周后,接受teprotumumab治疗的患者中,82.9%的患者眼球突出有明显改善,安慰剂组这一数值为9.5%。同时,teprotumumab达到所有次要终点,包括减少复视,生活质量改善等。
TED是威胁视力的罕见进行性严重自身免疫性疾病。是常发生在甲亢患者身上的独特疾病,病因是自身抗体激活了眼眶内细胞中胰岛素样生长因子1受体(IGF-1R)介导的信号复合体。
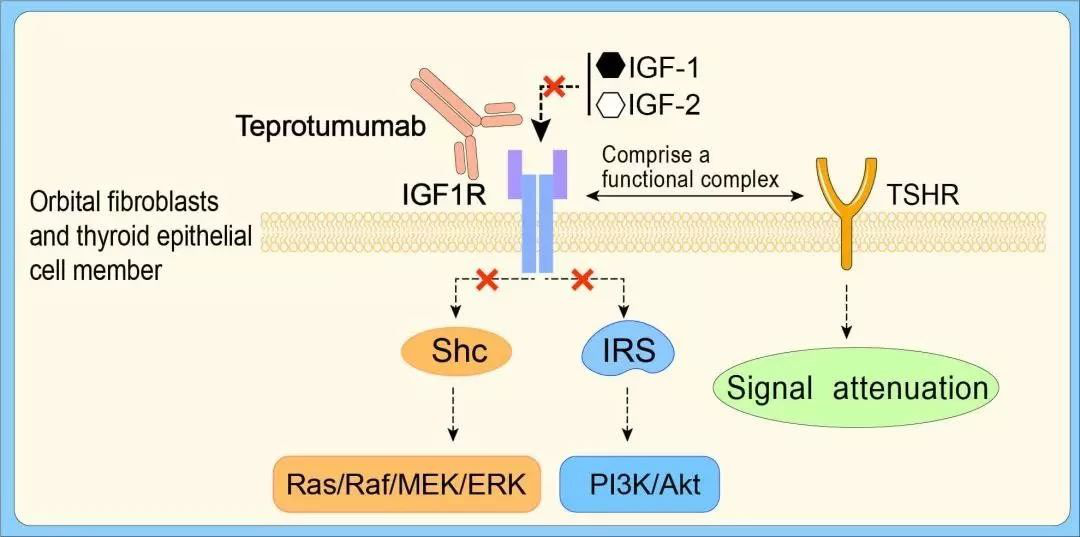
Teprotumumab的作用机制(图片来源:[15])
3. Tazverik(Tazemetostat Hydrobromide)
1月24日,FDA批准Epizyme公司的Tazverik(tazemetostat)上市,用于治疗无法完全切除的转移性/局部晚期上皮样肉瘤成人患者以及16岁以上的儿科患者。
Tazemetostat正被开发用于多种类型的血液系统恶性肿瘤(非霍奇金淋巴瘤:复发性或难治性弥漫性大B细胞淋巴瘤[DLBCL]、滤泡性淋巴瘤[FL])和基因定义的实体肿瘤(上皮样肉瘤、滑膜肉瘤、INI1阴性肿瘤、去势抵抗性前列腺癌、铂耐药实体瘤等)。
此次加速批准,基于一项II期临床试验,接受Tazemetostat治疗的患者ORR达到15%,其中CR为1.6%,PR为13%。另外,在所有产生应答的患者中,67%的患者持续反应时间达到6个月或更长时间。
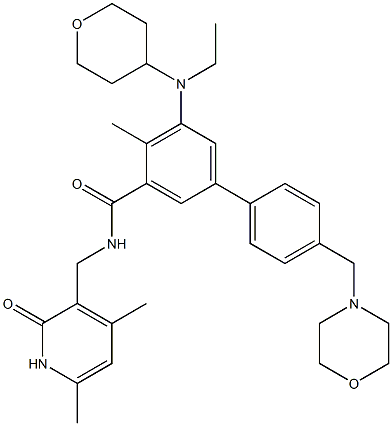
Tazemetostat分子结构式(图片来源:Chemical Book)
4. Pizensy (Lactitol)
2月12日,FDA批准Braintree实验室开发的Pizensy(lactitol)上市,用于治疗慢性特发性便秘(CIC)成人患者。
Pizensy是一种口服乳糖醇疗法,属于渗透性泻药,它能够促进水分进入肠道,进而达到通便作用。一项随机、双盲、安慰剂对照的多中心临床试验结果表明,Pizensy治疗组较安慰剂组患者在一周内达到3次完全自发排便次数(CSBMs)或者较基线比至少增加1次CSBMs的患者比例分别为25%和13%,到达主要终点。
该批准是基于Pizensy在治疗807名CIC患者中的试验结果,该试验使用患者较基线时完全自发排便(CSBMs)的分析结果作为终点评估Pizensy的疗效。试验结果表明,与安慰剂组相比,Pizensy治疗组中 25%的患者在给定的一周内至少达到了3次CSBMs,或较基线时至少增加1次CSBMs,而安慰剂组中达到这一标准的患者比例为 13%。
Pizensy是一种口服的乳果糖类似物。它是一种渗透性泻药(osmotic laxitaive),可促进水分流入肠道,进而在结肠内达到通便作用。
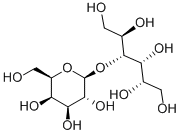
Lactitol分子结构式(图片来源:Chemical Book)
5. Nexletol (Bempedoic Acid)
2月21日,FDA批准Esperion公司的Nexletol(bempedoic acid)片剂上市,辅助饮食和最大耐受剂量他汀用于治疗成人杂合子型家族性高胆固醇血症(HeFH)患者,或者用于需要进一步降低LDL-C的动脉粥样硬化性心血管疾病(ASCVD)患者。Nexletol是自2002年以来批准的首个每日1次口服非他汀类降LDL-C药物。
Bempedoic acid抑制的ATP柠檬酸裂解酶是肝脏胆固醇合成过程中的的关键蛋白酶。通过抑制ATP柠檬酸裂解酶, bempedoic acid能够降低肝脏中LDL-C的合成,引发LDL受体(LDL-R)的表达水平上升。LDL受体水平的升高导致血液中更多的LDL-C能够被清除,降低血液中的LDL-C水平。

Bempedoic acid的作用机制(图片来源:Esperion公司官网)
Esperion公司汇集4项3期临床试验数据的分析表明,在患有高胆固醇血症的患者中,在接受最高耐受剂量的他汀疗法之上,bempedoic acid能够将LDL-C水平进一步降低18%。在无法耐受他汀疗法的患者中,与安慰剂相比,bempedoic acid能够将LDL-C水平降低25%。
6. Vyepti (Eptinezumab-Jjmr)
Vyepti(eptinezumab-jjmr)是一种人源化IgG1单克隆抗体,靶向结合降钙素相关基因肽(CGRP)配体,阻断其对受体的结合作用。
该药的上市意味着成为进入美国市场的第四种CGRP单抗药物。但Vyepti是第一个也是唯一的静脉内使用的CGRP抗体,因目前另外三种药物Amgen / Novartis的Aimovig,Teva的Ajovy和Eli Lilly的Emgality均使用皮下注射。Vyepti只需三个月进行一次给药,而其竞争对手则需要每月注射一次。静脉内给药意味着Vyepti的起效更快。
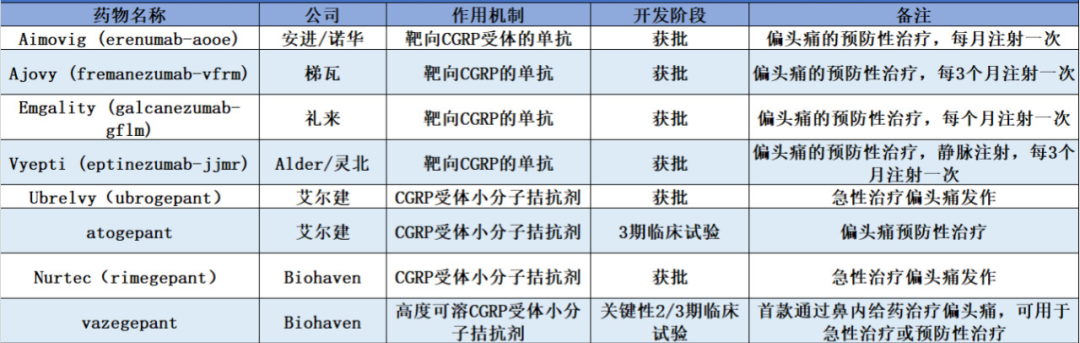
图片来源:药明康德内容团队制图
7. Barhemsys(Amisulpride)
Barhemsys是首款,也是唯一一款被批准用于对先前预防失败患者进行补救治疗的止吐药物。PONV是外科手术的常见并发症,大约30%的外科手术患者和80%的高危患者会发生这一病症。它与麻醉气体和阿片类止痛药的使用有关。在妇科,腹部,乳房,眼睛和耳朵的手术后,尤其是在持续一个小时或更长时间的手术后尤为常见。
Barhemsys的新药申请(NDA)涉及超过3300例手术患者和健康志愿者,其中包括4项阳性III期研究:
(1)一项随机、双盲、安慰剂对照III期研究的结果显示,在接受最常用止吐药预防性治疗PONV失败的患者中,单剂量10mg Barhemsys(n=230)在抢救性治疗PONV方面明显比安慰剂(n=235)更有效(呕吐完全缓解的患者比例:42% vs 29%,p=0.003)。
(2)另一项随机、双盲、安慰剂对照III期研究的结果显示,在发生PONV风险最高的患者(Apfel评分3或4)中,与安慰剂联合另一种止吐药(n=575)相比,单剂量5mg Barhemsys联合另一种止吐药(n=572)显著提高了对PONV的保护作用(呕吐完全缓解的患者比例:58% vs 47%;p<0.001)。
(3)4项关键研究中,Barhemsys治疗的患者中观察到的最常见的副作用(发生率≥2%患者,且高于安慰剂组)为:输注部位疼痛(6% vs 4%)、寒战(4% vs 3%)、低钾血症(4% vs 2%)、术中低血压(3% vs 2%)、腹胀(2% vs 1%)。
(4)在一项预防性研究中,对血清催乳素浓度进行了测量,Barhemsys治疗组有5%(9/176)血清催乳素升高报告为不良反应,而安慰剂治疗患者中为1%(1/166)。

8. Nurtec ODT (Rimegepant Sulfate)
Nurtec ODT的活性药物成分rimegepant是一种CGRP受体拮抗剂,通过可逆阻断CGRP受体,从而抑制CRP神经肽的生物活性。CGRP及其受体在与偏头痛病理生理学相关的神经系统区域表达。CGRP受体拮抗作用是偏头痛急性治疗的一种新的作用机制,与现有的曲坦类(血清素1B / 1D激动剂)和阿片类药物的作用机制明显不同。目前,CGRP受体已成为偏头痛药物研发的热门靶点。
Nurtec ODT是首个也是唯一一个获FDA批准的速效口腔崩解片(ODT)剂型的降钙素基因相关肽(CGRP)受体拮抗剂。在临床研究中,单次口服Nurtec ODT 75mg,可在1小时内迅速缓解疼痛,恢复正常功能,对许多患者的持续疗效可达48小时。Rimegepant通过阻断CGRP受体,治疗偏头痛的根源。FDA的批准是基于关键性3期临床试验和长期开放标签安全性研究的结果。在3期临床试验中,rimegepant达到消除疼痛和最困扰患者症状的双重主要终点。
9. Sarclisa(Isatuximab-Irfc)
Sarclisa的活性药物成分Isatuximab是一种IgG1嵌合单克隆抗体,靶向浆细胞CD38受体的特定表位,能够触发多种独特的作用机制,包括促进程序性肿瘤细胞死亡(凋亡)和免疫调节活性。CD38在多发性骨髓瘤(MM)细胞上呈高水平表达,是MM和其他恶性肿瘤中抗体治疗的细胞表面受体靶标。
在美国和欧盟,Isatuximab均被授予了治疗R/R MM的孤儿药资格。目前,赛诺菲也正在评估Isatuximab治疗其他血液系统恶性肿瘤和实体瘤的潜力。Sarclisa上市后将成为强生重磅CD38靶向药物Darzalex的第一个直接竞争对手,后者于2015年上市,2019年全球销售额达到29.98亿美元,较上一年增幅达48.0%。华尔街投资银行Jefferies分析师预计,Sarclisa上市后的年销售峰值将突破10亿美元。

10. Isturisa(Osilodrostat)
Isturisa的活性药物成分是osilodrostat,这是一种皮质醇合成抑制剂,通过抑制11-β羟化酶发挥作用,这种酶负责肾上腺皮质醇生物合成的最后一步。Isturisa的好处是它能够控制或使成人CS患者的皮质醇水平正常化,并具有可管理的安全性,使该产品成为CS患者有价值的治疗选择。
整个临床项目的数据表明,Osilodrostat可以使大多数患者皮质醇水平正常化,并改善该病的多种临床特征和生活质量,从而在医疗需求未得到满足的领域提供显著的临床效益。特别是,在LINC-3研究中,在8周随机撤药期结束时(第34周),Osilodrostat组患者保持正常mUFC的比例显著高于安慰剂组(86.1% vs 29.4%)。皮质醇水平控制是CS患者治疗的首要目标。
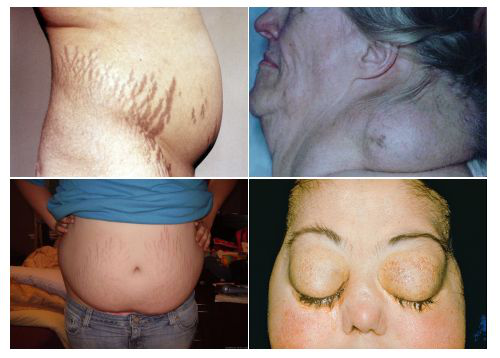
CS-库欣综合征症状
11. Zeposia(Ozanimod)
Zeposia的活性药物成分ozanimod是一种口服S1P受体调节剂,能以高亲和力选择性结合S1P1和S1P5。ozanimod选择性结合S1P1被认为能够抑制一个特定亚组的活化淋巴细胞迁移到炎症区域,减少可导致抗炎活性的循环T淋巴细胞与B淋巴细胞的水平,从而缓解免疫系统对神经髓鞘进行攻击。由于ozanimod的特殊作用机理,患者的免疫监视机能得以维持。而ozanimod与S1PR5的结合则能激活中枢神经系统内的特殊细胞,促进髓鞘再生,并预防突触出现缺陷,最终可预防神经损伤。在“减少损伤+加强修复”这2种机制的共同作用下,ozanimod有潜力改善多种免疫疾病的症状。
Zeposia上市后,将面临多款口服药物的竞争,例如诺华的Gilenya(第一代S1P受体调节剂)和Mayzent、赛诺菲的Aubagio、渤健的Tecfidera和Vumerity、默克的Mavenclad,以及罗氏的每年仅需输注2次的抗体药物Ocrevus。除了多发性硬化症之外,ozanimod目前也正被开发用于多种免疫炎症适应症,包括溃疡性结肠炎(UC)、克罗恩病(CD)等。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言