张锋团队最新Nature论文:细菌可作为治疗性蛋白的有效载体,或将改写基因治疗
2023-03-30 周晨 深究科学 ID: deepscience 发表于上海
最近,有研究者发现eCIS系统能靶向小鼠细胞,可用于治疗性蛋白质传递的可能性。但对于这些递送系统是否能在人类细胞中起作用,以及这些系统用来识别目标细胞的机制,人们了解不多。
导读
药物递送系统方面,最近又出现一项重磅研究。
3月30日,知名华人学者张锋及其团队又有了新发现:细菌或许能够成为治疗性蛋白质注射到人类细胞中的“注射器”。
在生物医学疗法方面,这个发现可能是一支“潜力股”,未来在基因疗法和癌症治疗方面可能大有一番作为。
张锋表示,“治疗分子的递送是医学的主要瓶颈,我们需要大量的选择才能将这些强大的新疗法送入体内正确的细胞,通过学习自然界如何运输蛋白质,我们能够开发一个新平台来帮助解决这一问题。”
01
细菌或成治疗性蛋白的“注射器”
共生菌已进化出复杂的输送系统,来实现这些生物体与宿主之间的相互作用,如细胞外收缩注射系统(eCISs)。
这一系统是一种类似注射器的大分子复合物,可通过在细胞膜表面诱导出一个刺突蛋白,从而将蛋白质注入真核细胞内。
最近,有研究者发现eCIS系统能靶向小鼠细胞,可用于治疗性蛋白质传递的可能性。但对于这些递送系统是否能在人类细胞中起作用,以及这些系统用来识别目标细胞的机制,人们了解不多。

3月30日,张锋及其团队发表在Nature上的论文就介绍了这方面的工作。
他们发现利用细菌“注射器”将蛋白质注射到人类细胞中,这种方法可能对未来人类生物医学疗法的应用很有前途,如基因疗法、癌症治疗。
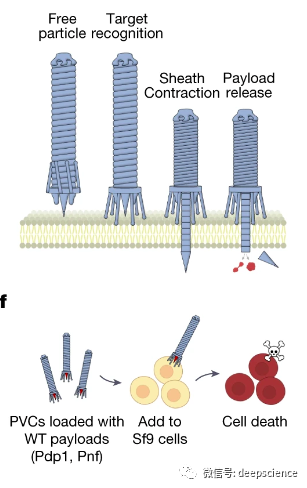
在这项研究中,张锋和同事使用AlphaFold预测了一种合适的、通常针对昆虫细胞的细菌蛋白结构,将之改造培养成适应人类细胞。
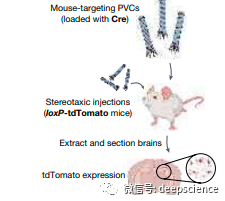
科学家还在小鼠身上试了一下该药物递送系统
结果发现,这一系统可用于高效递送多种类型的蛋白质到人类细胞。此外,研究者还调整了这一系统,用于针对活体小鼠的细胞,表明该系统也可用于在活体生物中引入蛋白质。
于是他们认为,这一系统有可能作为未来人类疗法的递送工具。
“这是蛋白质工程改变自然系统生物活性的一个非常好的例子”,论文第一作者、麻省理工学院生物工程研究生、张锋实验室成员 Joseph Kreitz 表示。
02
细菌收缩注射系统的分类
共生细菌使用大约 100 纳米长的类似注射器的结构将蛋白质注入宿主细胞,以帮助调整其周围环境的生物学并提高其生存能力,这些注射器被称为细胞外收缩注射系统 (eCIS)。

细菌收缩注射系统,图片来自mit.edu
细菌收缩注射系统(Contractile injection systems , CIS)是一种非常重要的细胞穿刺纳米装置,可以将细菌的核酸和蛋白质等效应因子转移到其它细胞中,介导细胞间的相互作用。
据工作机制的不同,细菌CIS可以大致分为两大类型:一类锚定在自身细胞膜上的常规CIS系统,另一类是细胞外CIS系统(extracellular CIS,eCIS),eCIS组装完成后分泌到细胞外(或者通过细胞自身裂解释放),以受体细胞膜为锚定点进行细胞攻击。
目前,经证实的eCIS系统包括了沙雷氏菌(Serratia)中的AFP系统、发光杆菌(Photorhabdus)中的PVC系统和假交替单胞菌(Pseudoalteromonas)中的MAC系统三种,并且都来自于来自革兰氏阴性菌。
03
新的递送系统或将改写基因治疗
张锋及其团队在《自然》杂志发表的这项新研究,发现发光杆菌中的PVC系统能够递送蛋白质到特定的细胞类型中,包括Cas9、碱基编辑和毒素。
他们发现该系统可定向特定受体的癌细胞,可几乎可以杀死 100% 的细胞,且不会影响没有受体的细胞。
研究人员还使用 eCIS 将蛋白质输送到活体小鼠的大脑——在那里它不会引发可检测到的免疫反应,这表明 eCIS 有朝一日可以用于向人类安全地输送基因疗法。
事实上,这也是目前基于AAV疗法的困境之一。
Kreitz表示,eCIS 系统是多功能的,他们已经用它来运送一系列货物,包括碱基编辑蛋白、对癌细胞有毒的蛋白质,以及 Cas9等。
“我们和其他人的工作已经表明,这种类型的系统在整个生物圈中具有令人难以置信的多样性,我们相信这种类型的系统在生物学中发挥着非常重要的作用。”Kreitz表示。
参考资料
1.Bacterial injection system delivers proteins in mice and human cells. MIT
2.杨国威/杨剑等揭示细菌细胞收缩注射系统多样性特征.分析测试百科.
3.生科高宁课题组与合作者报道一种细菌可收缩注射系统的精细结构 (pku.edu.cn)
4.Taylor, N. M., van Raaij, M. J. & Leiman, P. G. Contractile injection systems of bacteriophages and related systems. Molecular microbiology 108, 6-15 (2018).
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言