Cell:那些杀不死你的,会让你更强大,癌细胞亦如是
2022-09-09 生物世界 生物世界
该研究揭示了癌细胞如何在治疗药物的胁迫下“绝境逢生”——产生耐药性,存活下去并最终导致癌症的复发。这一发现可以作为药物的基础,通过抑制癌细胞获得这些持久性特征来防止其复发。
人在绝、境或遇险的时候,往往会发挥出不寻常的能力。当没有退路时,有的人就会产生一种爆发力,这种爆发力体现在体能、智力和协调能力等各个方面,让人能绝处逢生。著名哲学家尼采曾说过:那些杀不死你的,终将让你更强大。
作为智慧生命,人类乃至动物有这种潜能爆发的表现并不稀奇,而组成生命个体的最小单位——细胞,是否也会有类似的绝境逢生的能力呢?
2022年9月1日,美国圣裘德儿童研究医院的研究人员在估计顶尖学术期刊 Cell 上发表题为:ublethal cytochrome c release generates drug-tolerant persister cells 的研究论文。
该研究揭示了癌细胞如何在治疗药物的胁迫下“绝境逢生”——产生耐药性,存活下去并最终导致癌症的复发。这一发现可以作为药物的基础,通过抑制癌细胞获得这些持久性特征来防止其复发。

在癌症治疗中,有一小部分癌细胞会成为“钉子户”,产生耐药性并在治疗后持续存在,这些“持续存在”的癌细胞可以重新构成同一种癌症的一种更具侵袭性的形式。然而,到目前为止,科学家们仍不清楚这些癌细胞是如何获得耐药性的。

Douglas Green
该研究的通讯作者 Douglas Green 博士表示,对于癌细胞来说,杀不死它们的终将使它们更加强大。这项研究提出了一种概念——这种“濒死体验”可能是耐药性癌细胞产生的原因。这是出乎意料的,就像找到了藏宝图上的一块你从来不知道丢失了的东西——新的发现之路已经打开了。
“濒死体验”使癌细胞更加强大
许多治疗癌症的药物都会引发细胞凋亡,其中,线粒体中细胞色素c蛋白的释放是导致细胞凋亡的关键事件。在过去,科学家们认为,一旦细胞色素c被释放到细胞质种,细胞凋亡就无法停止。然而,近年来越来越多的研究表明,一些细胞也会在这一过程中存活下来,但目前尚不清楚这样的存活如何或为什么会导致更恶性的癌症。
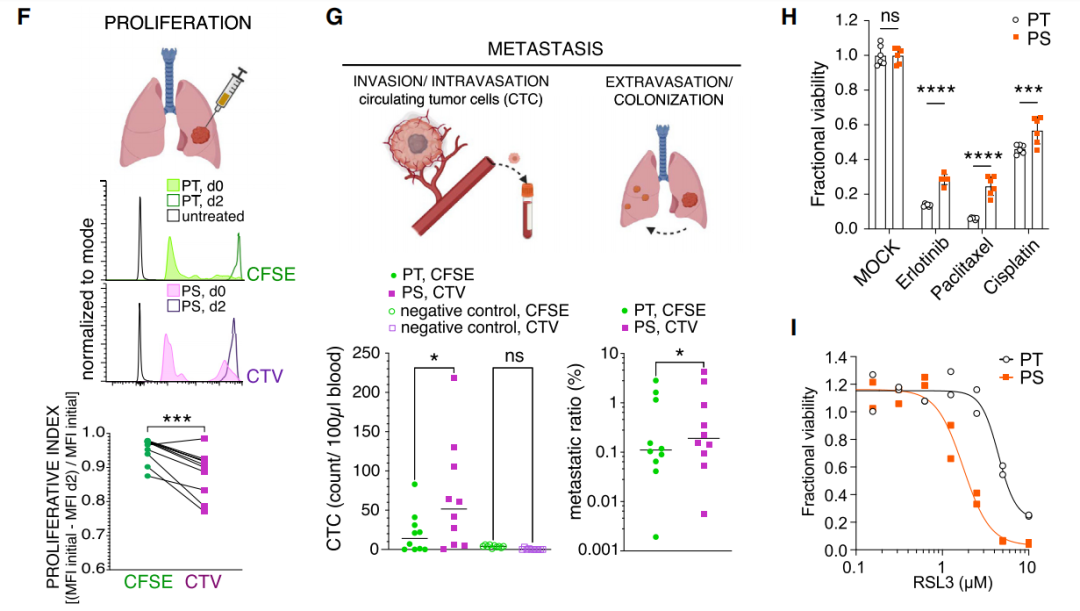
靶向细胞凋亡的癌症治疗药物诱导持续性细胞的产生
在这项最新研究中,研究团队发现这些持久性细胞虽然确实开始凋亡,但最终的走向却是截然相反,这种“濒死体验”反而成为了它们存活的关键。研究人员表明,细胞色素c的释放也会启动另一个过程——综合应激反应(ISR),它可以停止细胞凋亡,并促进延长生存的基因表达。
该研究的通讯作者 Douglas Green 博士表示,这种持久性细胞是由参与线粒体凋亡途径而不死亡的“濒死体验”造成的。这项研究发现,存活细胞的生成需要一个过程,即细胞色素c释放,但细胞不凋亡,而是存活下来,成为持久性细胞。实际上,这些细胞经历了‘凋亡失败’。
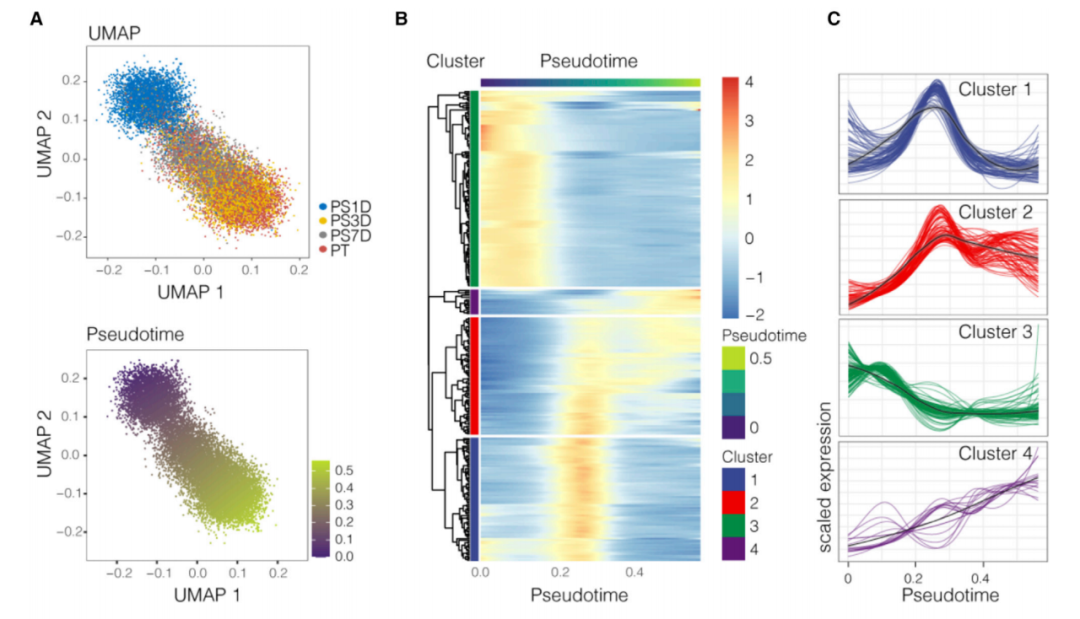
转录组学轨迹分析揭示了持久性细胞中短暂的ISR表达谱
这一新发现也解释了为什么癌细胞很容易对治疗药物产生耐药性:虽然这些治疗药物有不同的作用机制,但大多数药物最终都会诱导细胞凋亡。当细胞凋亡被抑制,这些持久性细胞对癌症治疗有普遍的耐药性。
潜在的药物靶点
更重要的是,这项研究可以为通过干扰应激反应中的关键蛋白来预防癌症复发的药物提供基础。
在持续性细胞中,应激反应导致细胞内蛋白激活转录因子4(ATF4)增加。ATF4是应激反应的主要调节因子,导致促进细胞死亡的蛋白质的消除和促进生存的基因的上调。由ATF4引起的基因表达变化似乎对持久细胞至关重要,如果ATF4被敲除或抑制,癌细胞就无法抵抗最初的癌症治疗。此外,激活ATF4但血红素调节抑制剂(HRI)被移除或抑制时,也会发生同样的情况。
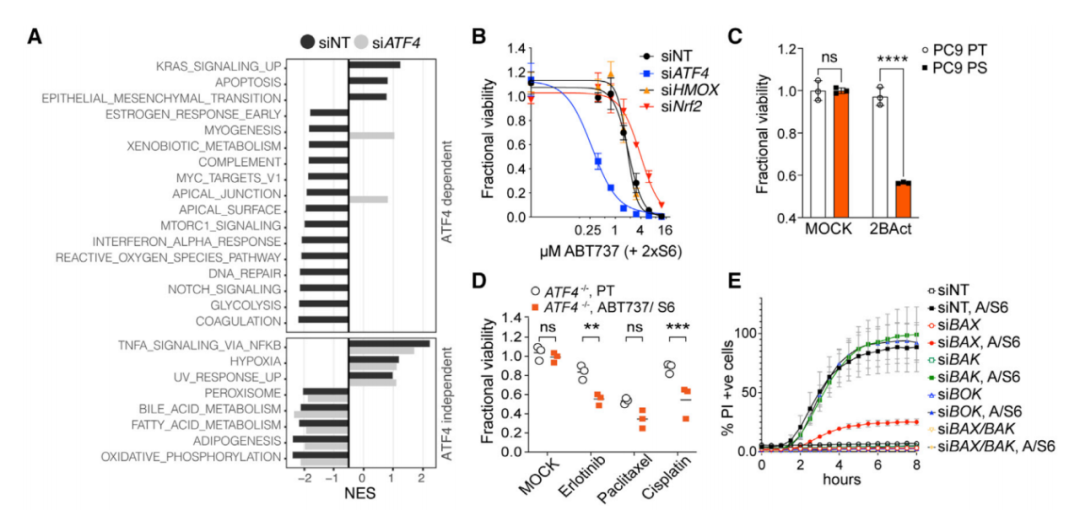
细胞色素c-HRI-ATF4轴驱动持久性表型
研究小组发现,在持续性细胞中受ATF4调控的基因在化疗后存活的患者的癌细胞中也受到类似的调控,这表明这一过程确实发生在癌症治疗过程中。
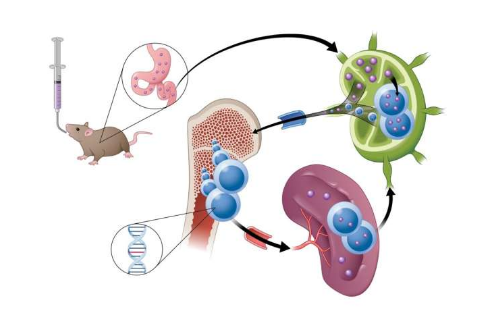
综上所述,这项研究解释了癌细胞耐药性产生的机制:当癌细胞受到促凋亡药物的作用时,细胞色素c被释放到细胞质中,进而诱导血红素调节抑制剂(HRI)激酶的激活和综合应激反应(ISR)与ATF4的合成,然后ATF4将细胞从死亡状态变为存活状态。
一言蔽之,在细胞凋亡药物的治疗下,细胞色素c-HRI-ATF4轴的激活驱动持久性细胞的产生,诱导癌细胞耐药性,最终导致癌症的复发。
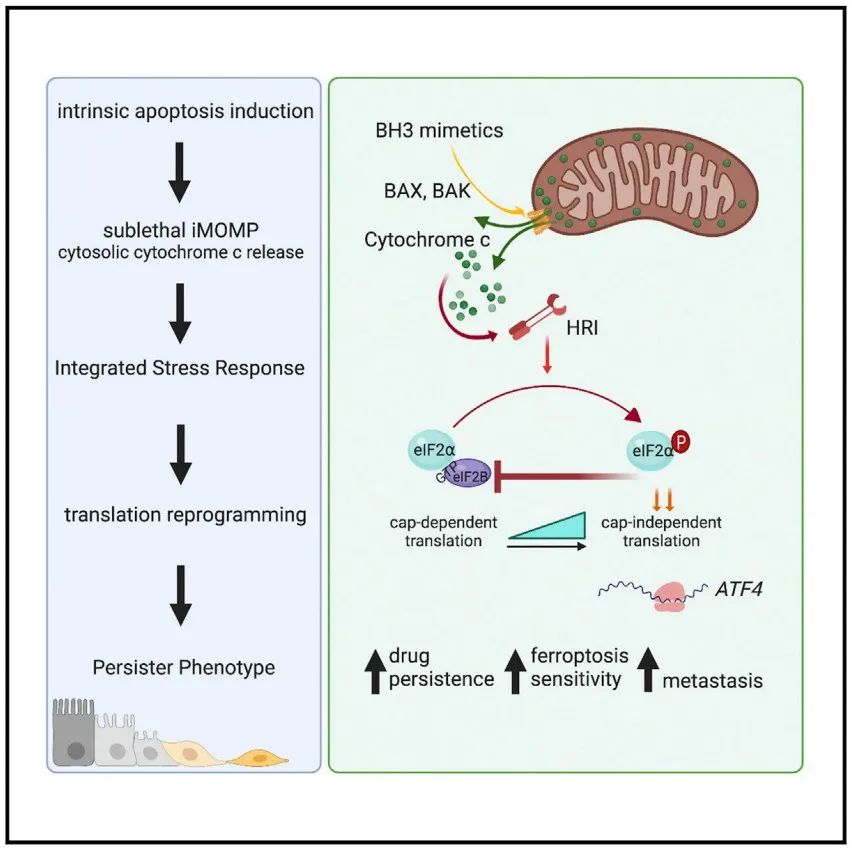
研究模式图
研究团队表示,他们人工诱导的持续性细胞比原始癌细胞更具攻击性,在小鼠模型中形成更多的克隆,这些特征与复发性肿瘤的转移性质相匹配。这一新发现将指导预防耐药性癌细胞产生的治疗药物的研发。
论文链接:
https://doi.org/10.1016/j.cell.2022.07.025
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#CEL#
36
#Cell#
30
#癌细胞#
59