NMPA 上半年批准 31 个新药,国产近一半
2020-07-18 MedSci原创 MedSci原创
2020年上半年,NMPA共批准31个新药上市(按照注册分类 1 类、国内首次获批的进口药、中药新药、及按照新药程序申报的生物制品 2 、15 类统计),包括17个进口药品和14个国产药品。从药物类型
2020年上半年,NMPA共批准31个新药上市(按照注册分类 1 类、国内首次获批的进口药、中药新药、及按照新药程序申报的生物制品 2 、15 类统计),包括17个进口药品和14个国产药品。从药物类型来看,包括13个化药、10个生物药、3个中药和1个疫苗产品。2020 上半年 NMPA 共批准 212 个药品批件,涉及 146 个品种,按品种成分类别看化药占 85%,其次是单特异性抗体约占 4%。

31 个新药平均审评时长为 511 天,其中,审评用时最短的氘代丁苯那嗪片仅 139 天就获批上市, 该药用于治疗罕见病亨廷顿舞蹈症,是国家公布的临床急需境外新药品种,享受加速审评的政策通道。
整体看来,进口新药大部分具有临床优势、或者用于特殊患者群体且国外已获批,审评时长要短于国产新药。
上半年获批的新药中有 11 个为化药新药,其中包括 4 个国产 1 类新药,分别来自豪森的甲磺酸奥美替尼片、百济神州的赞布替尼胶囊、凯因科技的可洛派韦胶囊(KW-136)和银谷制药的苯环喹溴铵鼻用喷雾剂。豪森药业的阿美替尼是我国批准的首个国产三代 EGFR-TKI 抑制剂、百济神州的泽布替尼是首个获批的原研 BTK 抑制剂,凯因科技的可洛派韦是继歌礼达诺瑞韦之后批准的第二个国产 1 类丙肝新药,银谷制药的苯环喹溴铵鼻喷雾剂也是我国自主研发的一款 1 类新药。
国产生物药上半年也收获满满,三生制药的伊尼妥单抗是利用其自身平台技术自主研发的针对抗 HER2 治疗的一款「仿创结合」的抗 HER2 单抗;信达生物的贝伐珠单抗是国内批准的第二款贝伐珠单抗生物类似物;甘李药业的门冬胰岛素是首个国产门冬胰岛素类似物;智飞生物的重组结核杆菌融合蛋白(EC,商品名宜卡)是我国自主研发的 1 类新药,用于结核杆菌感染的筛查。
在 2020 上半年适应症扩大领域最为瞩目的当属 PD-1/L1 单抗,恒瑞医药的卡瑞利珠单抗获批 3 个新适应症,即二线治疗肝癌、肺癌和食管癌;百济神州的替雷利珠单抗获批二线治疗尿路上皮癌;欧狄沃获批用于治疗胃或胃食管连接部腺癌;可瑞达获批二线治疗食管鳞癌;泰圣奇获批一线治疗广泛期的小细胞肺癌等。
2020上半年在中国获批上市的5.1类新药中,先声药业拥有阿巴西普的中国权益,北海康城拥有奈拉替尼的中国权益,复星医药拥有阿伐曲泊帕的中国权益。另外,Asahi Kasei 公司的萘哌地尔和GSK的盐酸安非他酮缓释片属于原研首次在中国上市,国内已有多家仿制药获批。
从企业来看,2020上半年,罗氏、武田、赛诺菲和协和发酵麒麟均有2款新药在中国获批上市。其中,罗氏的恩美曲妥珠单抗为首个在国内获批上市的抗体偶联药物(ADC),阿替利珠单抗为第2个在中国获批的PD-L1药物。武田的维布妥昔单抗则为第2个在中国获批的ADC药物。
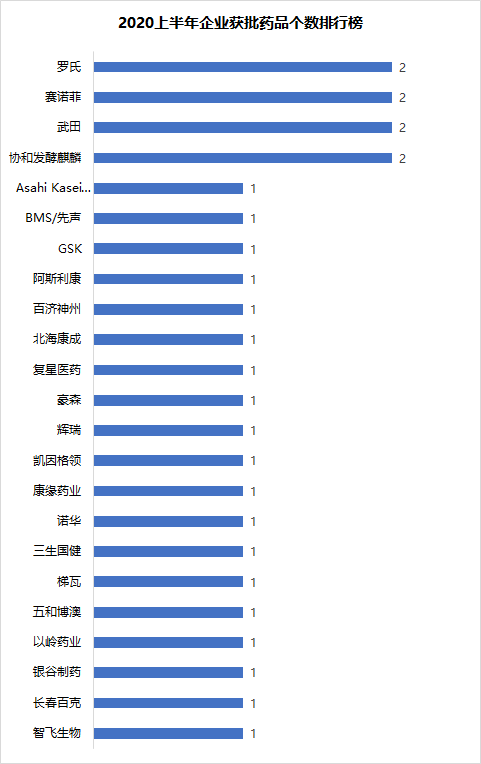
另外,2020年获批上市的17个进口药品中,有6个属于临床急需境外用药。从审批天数来看,除柏达鲁单抗为递交临床申请后直接获批上市外,其余5个药品平均审批时间为213天。其中,氘代丁苯那嗪片仅用时115天便在中国获批上市。
2020上半年获批的临床急需境外用药
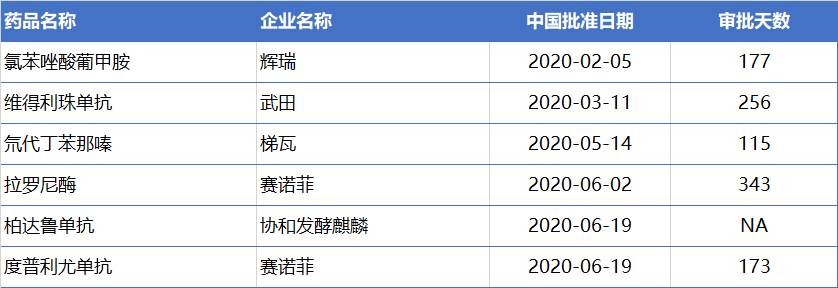
注:不包括新适应症申请
以下选取部分新药做一简单介绍:
1.首个国内获批上市的抗体偶联药物
罗氏恩美曲妥珠单抗于2020年1月在中国获批,主要用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗,也填补了我国HER2阳性乳腺癌患者在新辅助治疗后未达到病理完全缓解(pCR)的治疗空白。
该适应症在美国和欧盟获批的时间分别为2019年5月和2019年12月,实现了中国和欧美国家的同步批准。
2.近10年来首个糖尿病中药新药
五和博澳的桑枝总生物碱片主要用于配合饮食控制及运动治疗2型糖尿病。该药III期临床证明疗效与阿卡波糖相似,是近10年来首个获批的糖尿病中药新药。
3.首个国产三代EGFR-TKI药物
豪森的甲磺酸阿美替尼片主要用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者。这是全球第3个三代EGFR-TKI创新药,也是首个国产三代EGFR-TKI药物。
4.首个氘代药物
梯瓦的氘代丁苯那嗪片主要用于治疗与亨廷顿病有关的舞蹈病及成人迟发性运动障碍。这是FDA批准的首个氘代产品,也是针对与亨廷顿病有关的舞蹈病的历史上第2个药物。中国是继美国之后第2个批准该药物的国家,这也是中国首个获批的氘代药物。
5.首个国产BTK抑制剂
百济神州的泽布替尼是首个获得美国FDA批准的本土研发抗癌新药,也是国内首个上市的国产BTK抑制剂。目前,百济神州已经在欧盟提交泽布替尼治疗华氏巨球蛋白血症患者的上市许可申请。
6.首个特应性皮炎靶向生物制剂
赛诺菲Dupilumab注射液是全球首个获批治疗成人中重度特应性皮炎的靶向生物制剂。Dupixent是一款靶向IL-4R的单克隆抗体药物,于2017年3月首次获得FDA批准,2019年全球销售收入即达到20.74亿欧元,赛诺菲计划将其打造为年销售额过100亿欧元的重磅炸弹。
(上述信息来自医药魔方和insight等)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言