CSCO2022|吴一龙教授:KRAS靶向药物在NSCLC治疗中的进展
2022-11-16 梅斯医学 梅斯医学
CSCO2022|吴一龙教授:KRAS靶向药物在NSCLC治疗中的进展
近日,第25届全国临床肿瘤学大会暨2022年中国临床肿瘤学会(CSCO)学术年会顺利召开,作为我国肿瘤学界最受关注的领域盛会,本次大会前沿学术进展引人期待。在11月8日举办的非小细胞肺癌靶向治疗专场上,广东省人民医院吴一龙教授带来了题为“驱动基因阳性晚期NSCLC治疗进展 KRAS篇”的主题报告,勾勒出了KRAS靶向治疗的生动图景,下面我们一起来具体学习一下吴一龙教授的报告。

肺癌是我国最常见的恶性肿瘤,其发病率及死亡率均居恶性肿瘤首位,其中非小细胞肺癌(NSCLC)占肺癌总数的 80%-85%。目前,已发现的肺癌的驱动基因已达数十种(EGFR、ALK、ROS1、HER2、MET、RET、KRAS、NTRK、BRAF 等)。
RAS基因突变是最常见的人类致癌基因突变,大约有30%的癌症发生该基因突变。RAS基因家族有三个成员:KRAS, HRAS和NRAS,85%的RAS基因突变是发生在KRAS亚型,KRAS基因全称Kirsten大鼠肉瘤病毒癌基因同源物(Kirsten rats arcomaviral oncogene homolog)是人类发现第一个癌基因。它对应控制的KRAS蛋白是一种比较小的蛋白质,分布在细胞膜的内侧,这与细胞的生长、分化、增殖等过程息息相关。KRAS基因突变引起的肿瘤非常广泛,比如肺癌、结直肠癌、乳腺癌、胰腺癌、肝癌、甲状腺癌等常见,这其中有80%发生在密码子12,最常见的突变是G12D,G12V 和G12C。
KRASG12C抑制剂单药治疗
Sotorasib是首个针对KRAS G12C的抑制剂,基于1/2期、全球、单臂CodeBreaK100研究结果,2021年5月,FDA批准Sotorasib用于既往接受过系统治疗的KRAS p.G12C突变局部晚期或转移性非小细胞肺癌(NSCLC)患者。在2期CodeBreaK100研究中,中位随访15.3个月,Sotorasib的客观缓解率(ORR)为37.1%,中位无进展生存期(PFS)为6.8个月,中位总生存期(OS)为12.5个月。

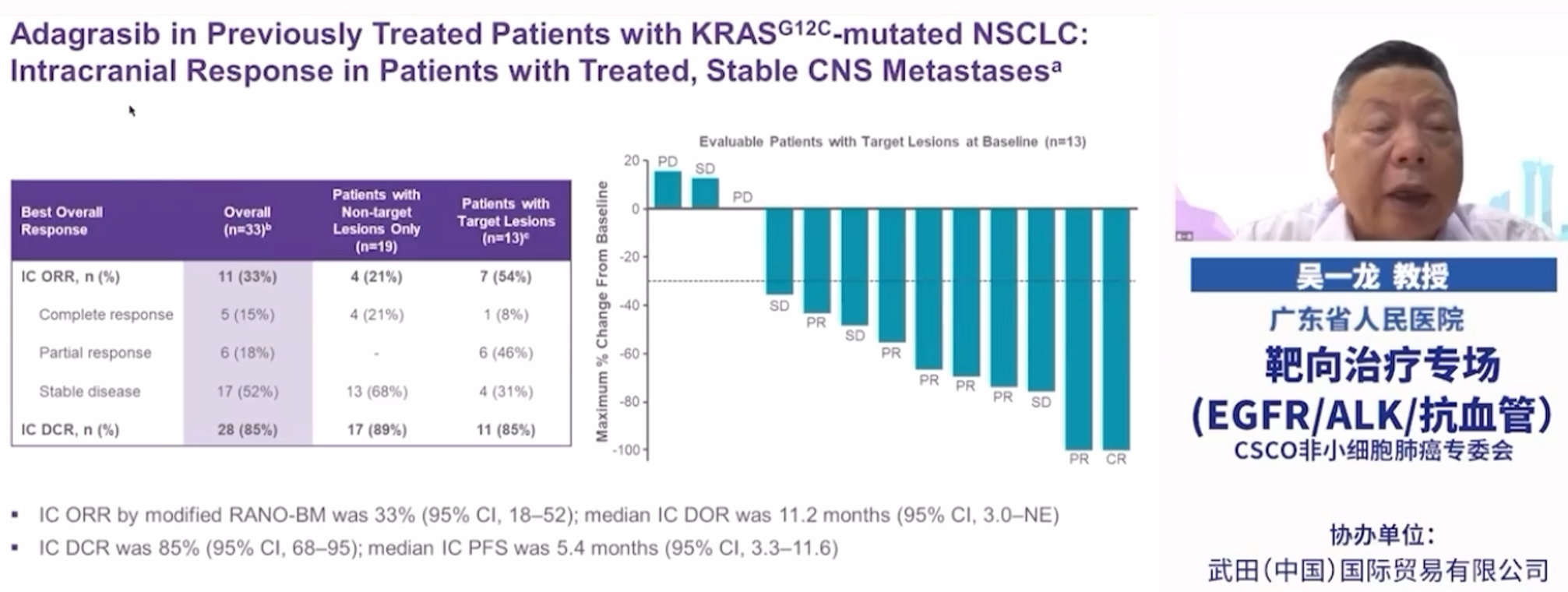
KRYSTAL-1试验结果显示Adgrasib用于经治的KRASG12C突变非小细胞肺癌(NSCLC)患者,起效迅速且出现深度应答,并转化为生存改善。
CodeBreaK 200是一项随机对照、多中心、开放标签的III期研究,旨在评估Sotorasib(每日口服一次)与多西他赛在治疗携带KRASG12C突变的NSCLC患者中的有效性和安全性,这些患者既往接受过基于铂类的化疗和免疫检查点抑制剂治疗。该项研究共纳入345例患者,主要终点是PFS,关键次要终点包括总生存期、客观缓解率以及患者报告结局。2022年8月31日,安进宣布,KRAS抑制剂Sotorasib(Lumakras,AMG510)的III期CodeBreaK 200研究达到了无进展生存期(PFS)的主要终点,显示出优于标准化疗多西他赛的显著改善。Sotorasib作为首款KRASG12C抑制剂,与多西他赛相比,在治疗KRASG12C突变的晚期NSCLC中,显著延长PFS。经BICR评估的PFS,sotorasib 5.6个月优于多西他赛4.5个月(HR0.66,P=0.002),12个月的PFS率,sotorasib为24.8%,多西他赛为10.1%。

虽然KRAS不再不可成药,但KRAS抑制剂的单一疗法远远不够。事实上,可塑性和遗传不稳定性使肿瘤对所有单药靶向治疗产生耐药性,KRAS靶向治疗也不例外。以sotorasib用于KRASG12C突变NSCLC的批准为例,客观缓解率(ORR)仅为约41%,中位无进展生存期(PFS)仅为6.3个月,2年总生存期(OS)约为30%。在这个靶向KRAS突变的新时代,下一个挑战将是理解耐药机制和克服耐药。

联合用药提高KRAS抑制剂功效
KRASG12C抑制剂可诱导肿瘤微环境(TME)的重构,例如增强抗原提呈细胞(APC)的摄取能力,提高T细胞对肿瘤的杀伤作用,增强内源性和外源性干扰素(IFN)的响应性等。同时研究者们在实验中发现,KRASG12C抑制剂和ICB联合,可成功抑制某些免疫原性的肺癌。
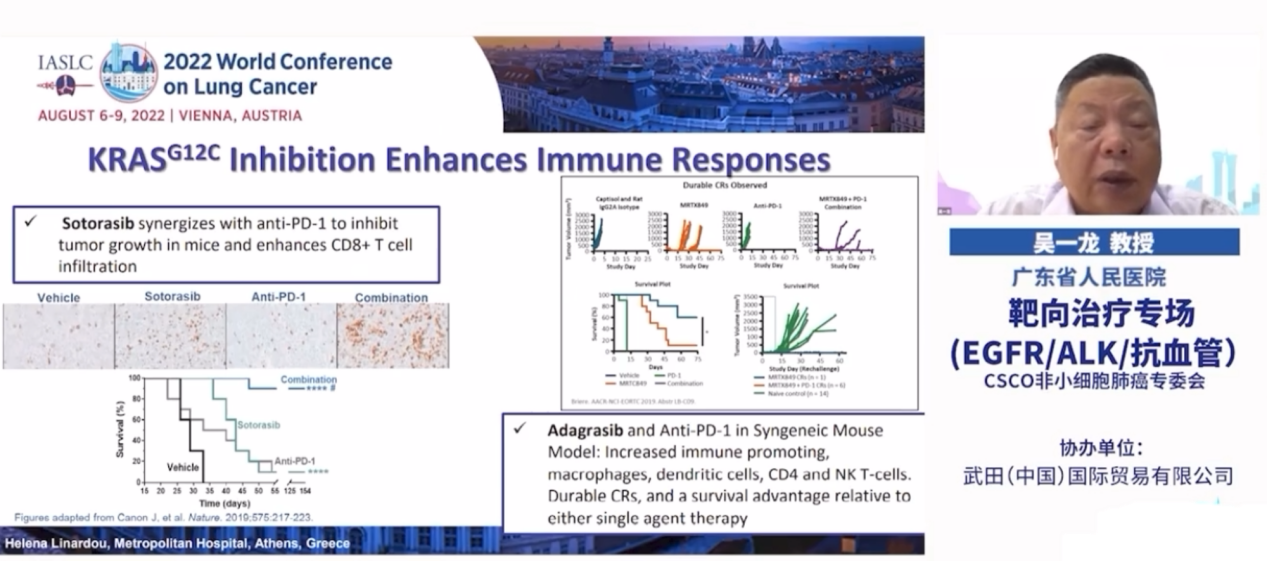
CodeBreaK100 Ph1/2 试验发现受体酪氨酸激酶 (RTK) 的基因组改变为 sotorasib 的常见推定耐药机制,突出了 sotorasib 与上游 RTK 信号转导抑制剂联用的潜在作用。在小鼠异种移植模型中,sotorasib与 SHP2 抑制剂 (SHP2i) 联合给药损害了 RAS 的 RTK 信号传导,并增强了抗肿瘤疗效。sotorasib 联合 RMC-4630 在KRAS p.G12C突变实体瘤患者中安全且可耐受。在KRAS p.G12C突变的 NSCLC 患者中观察到了具有前景的临床活性,在未接受过 KRASG12C 抑制剂的患者中最为明显。

未来可能的突破
新型KRASG12C抑制剂在前期实验中表现出更加强大的性能,有望实现新的突破。JDQ443 是一种结构独特的KRASG12C共价抑制剂,在KRAS G12C突变细胞系(包括G12C/H95双突变)中表现出选择性增殖抑制活性。在体内,JDQ443在KRASG12C突变细胞CDX和PDX抗肿瘤效果明显。在PDX模型中,JDQ443联用SHP2、MEK或CDK4/6抑制剂药效增强。在CDX模型中,与TNO155联合使用时将JDQ443的剂量减少,也可以达到与单独使用JDQ443相似的靶区占有率和抗肿瘤活性。
GDC-6036是一种口服、高效、选择性KRASG12C抑制剂,多个临床前模型证实其具有强效肿瘤生长抑制作用。目前,一项关于携带KRASG12C突变的局部晚期或转移性实体瘤患者中进行GDC-6036单药或联合治疗的开放性、I期剂量递增/扩展研究正在进行。
APG1842可以完全阻断GDP-GTP核苷酸交换,稳定KRASG12C的非活性GDP结合形式,从而抑制了KRASG12C突变的NSCLC患者的NCI-H358细胞中RAS和RAF的结合。

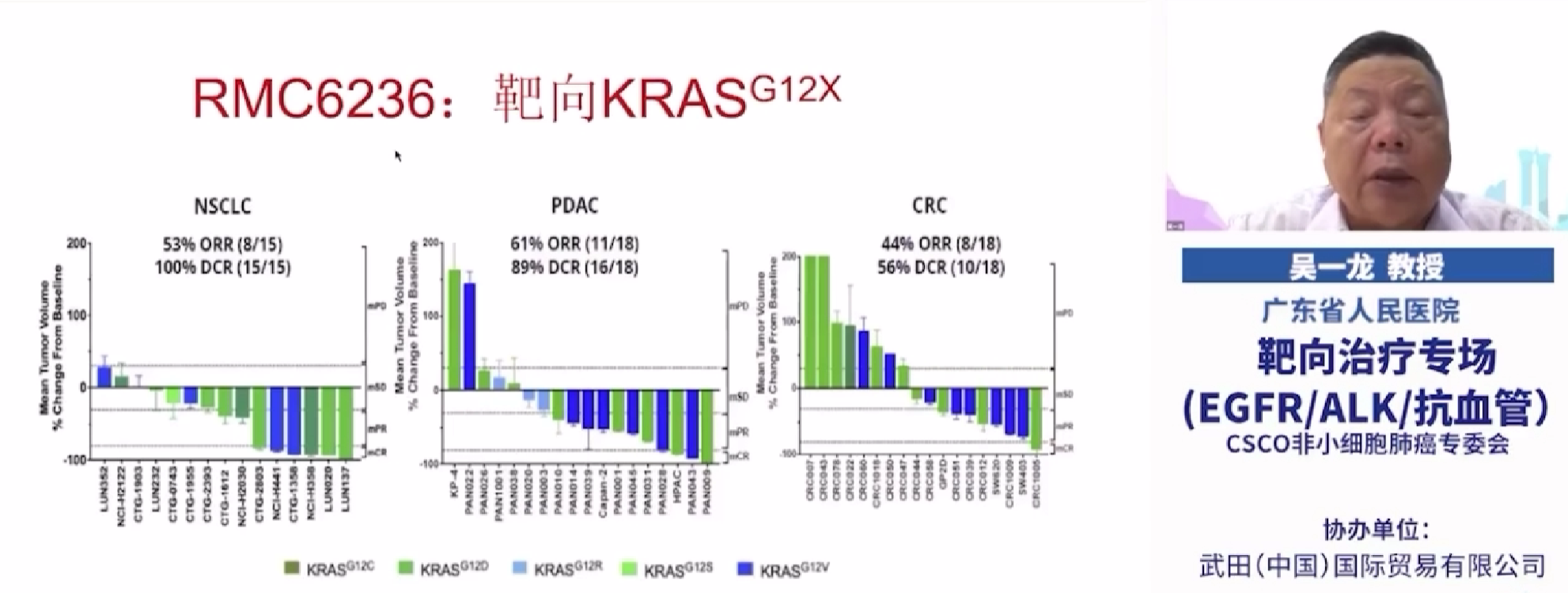
RMC-6236 是一种口服 RAS(ON) 抑制剂,旨在治疗由多种 RAS 突变驱动的癌症患者,包括 KRAS G12D、 KRAS G12V和 KRAS G12R。
靶向蛋白质降解 (TPD) 是一种富有前景的治疗策略,可降解与疾病相关的致病靶蛋白。该策略可以用于以往由于缺乏药物结合口袋而被认为是“不可成药”靶点的药物开发,以及克服因获得性突变耐药或机体代偿途径而出现的对常规治疗产生耐药等问题。

总的来说,吴一龙教授从单药治疗、联合治疗、未来可能的突破三个方面就KRAS突变诊疗难点、前沿进展与未来发展方向进行分享,并指出,KRAS突变靶向治疗方兴未艾,未来还将有更大的发展,值得更多的期待。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言