Mole Cell:湖北医药学院李珊/南方科技大学傅暘揭示细菌效应物和宿主钙调素催化的半胱天冬酶ADPR去酰化的机制
2022-11-25 iNature iNature 发表于上海
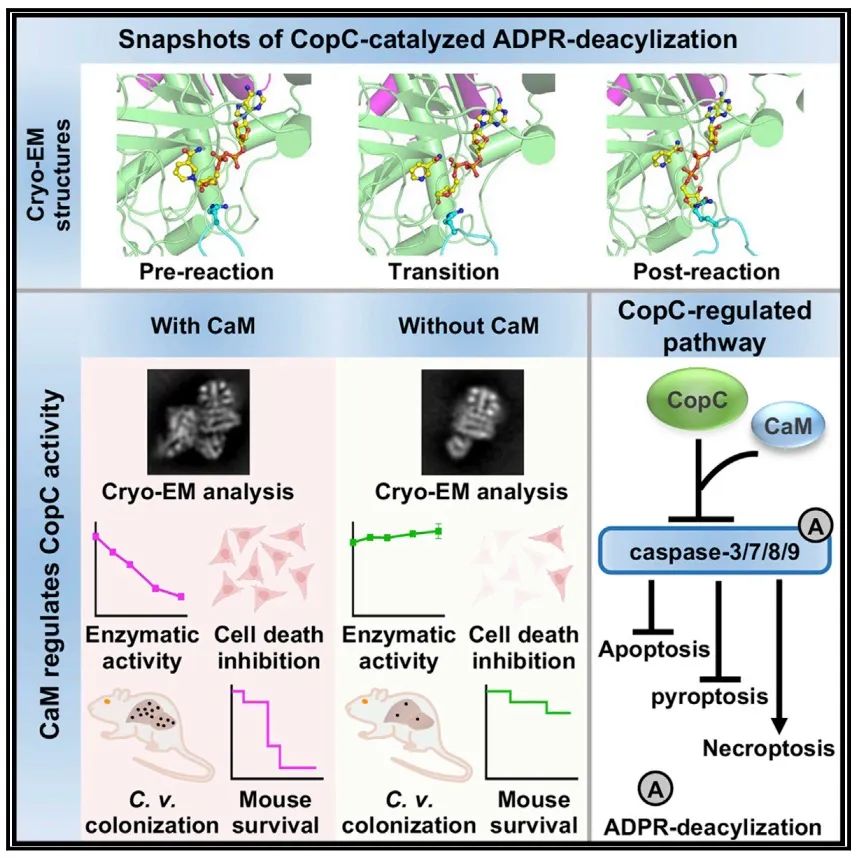
该研究确定了CaM-CopC-caspase-3三元配合物在反应前、过渡和反应后状态下的连续冷冻电镜结构,阐明了CopC催化ADPR去酰化的多步骤酶机制。
程序性细胞死亡和caspase蛋白在宿主对抗病原体感染的先天免疫反应中起着关键作用。阻断细胞死亡被许多细菌病原体作为一种通用的毒力策略。CopC家族III型效应器,包括来自环境病原体C. violaceum (紫色色杆菌)的CopC,利用钙调素(calmodulin, CaM)作为辅助因子,通过精氨酸ADPR去酰化使caspase失活。然而,催化的分子基础和底物/辅助因子结合机制尚不清楚。
2022年11月23日,湖北医药学院李珊团队与南方科技大学医学院傅暘团队合作在Molecular Cell 杂志在线发表题为“Structural insights into caspase ADPR deacylization catalyzed by a bacterial effector and host calmodulin”的研究论文,该研究确定了CaM-CopC-caspase-3三元配合物在反应前、过渡和反应后状态下的连续冷冻电镜结构,阐明了CopC催化ADPR去酰化的多步骤酶机制。
此外,该研究捕获了修饰的caspase-3从CopC分离的快照。这些结构见解通过体外CopC介导的ADPR去酰化突变分析和动物体内感染得到验证。总之,这项研究为理解CopC家族催化精氨酸ADPR脱酰基反应的分子基础提供了一个结构框架。

半胱天冬酶是一种进化上保守的酶家族,主要参与细胞死亡和炎症反应。caspase通过三个高度保守的残基识别底物切割位点,对应于caspase-3中的Arg64、Gln161和Arg207。宿主细胞通常通过诱导细胞程序性死亡来消除受感染的细胞龛来对抗病原体。然而,在宿主和病原体之间的进化“竞赛”中,细菌病原体已经进化出复杂的策略来劫持宿主细胞的死亡途径。
细菌病原体已经进化出了专门的蛋白质分泌系统,如III型分泌系统( type III secretion system, T3SS),将名为效应器的毒力因子输送到宿主细胞中。它们操纵宿主信号通路,以促进感染和逃避先天免疫防御。该研究团队最近报道了C. violaceum效应器CopC和S. flexneri效应器OspCs代表了存在于各种细菌中的一个酶家族,可以催化一种新的翻译后修饰。CopC利用钙调素(calmodulin, CaM)作为辅助因子,将ADPribose转移到小亚基中高度保守的caspase-3/-7/-8/-9的精氨酸上,然后从ADP -核基化的精氨酸中去除一个氨分子,并介导精氨酸胍基与核糖之间的环化反应。这一过程最终导致caspases大量增加524 Da,从而调节宿主程序性细胞死亡途径。
ADP核基化是一种广泛存在于生命的修饰。ADP -核基转移酶(ADP-ribosyltransferases, ARTs)催化ADP -核基化蛋白,根据其ART结构域与霍乱毒素(ART霍乱毒素样[ARTC])或白喉毒素(ART白喉毒素样[ARTD])的同源性,将其分为两类。前者具有R-S-E或R-S-ExE基序,后者具有H-Y-E或H-Y-E变体基序。ARTs的靶残基可以是Arg, Lys, His, Cys, Ser, Glu, Gln, Asp, Asn, Thr,这大大增加了ADP核基化的多样性。为了维持ADP核糖基化的动态平衡,哺乳动物细胞使用另一种称为ADP核糖基化水解酶的酶家族,通过从各自的靶标上分离ADP核糖修饰来逆转ADP核糖基化。
然而,该研究发现CopC家族催化的ADPR去酰化不能被ADP核糖水解酶去除。已经在一些晶体结构和质谱分析中观察到传统的精氨酸ADP核基化发生在胍基的NH2原子上。有趣的是,该研究通过1,2-环己二酮(1,2-cyclohexanedione, CHD)化学反应和随后的质谱测定证实了CopC家族催化的ADPR去酰化的第一步发生在caspase-3 Arg207的NH原子上。
在这项研究中,研究人员确定了CaMCopC-caspase-3复合体与不同状态的NAD+相协调的结构。通过将NAD+结合的CaM-CopC-caspase-3配合物结构作为反应前态,ADP -核糖结合的CaMCopC-caspase-3配合物结构作为过渡态,ADP去酰化修饰的CaM-CopC-caspase-3配合物结构作为反应后态。这些为CopC识别caspase底物和催化精氨酸ADPR去酰化的所有主要步骤提供了结构框架。
进一步研究表明辅助因子CaM通过钳制N -螺旋周围区域促进CopC N端催化结构域(N-terminal catalytic domain, NCD)的组织。CopC家族蛋白具有独特的H-F-F-D基序用于配体结合和催化。此外,结合结构和生化分析,研究人就阐明了CopC通过广泛的相互作用识别caspase-3需要其NCD和C端锚结蛋白重复序列域(C-terminal ankyrin repeats domain, ANK)。此外,还为精氨酸NE原子的ADPR去酰化提供了结构证据,揭示了CopC催化反应的分子机制。
研究概述(图源自Molecular Cell )
综上所述,这些结构上的发现得到了CopC促进C. violaceum致病性的功能分析的支持,为细菌毒力效应因子CopC家族对精氨酸ADPR去酰化的机制研究建立了结构框架。
原文链接:
https://doi.org/10.1016/j.molcel.2022.10.032
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








湖北医药学院 y y d s
43