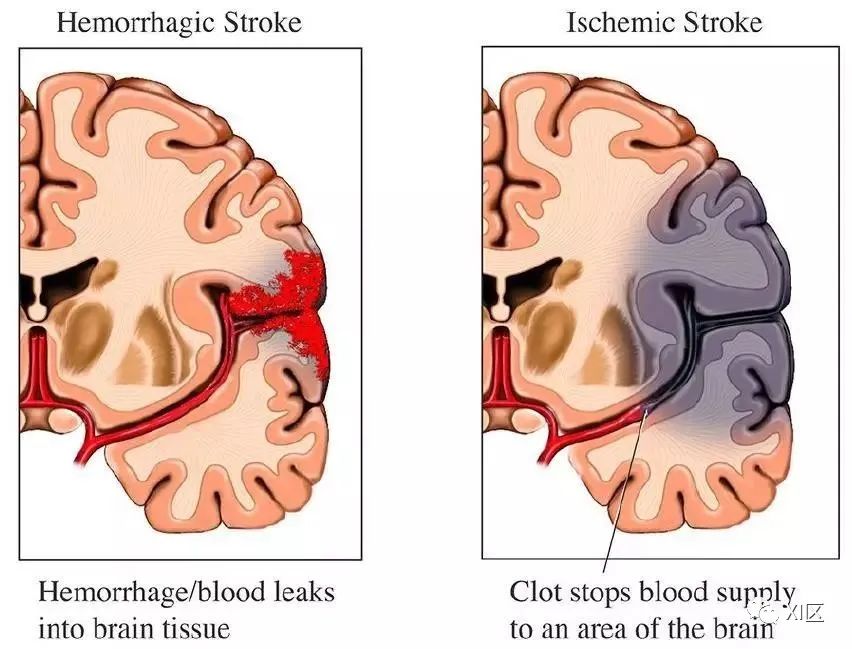
静脉-静脉体外膜氧合缺血性和出血性卒中的危险因素:体外生命支持组织注册数据分析
2023-02-08 网络 网络 发表于上海
本研究将探究 ECMO 前和ECMO 期间患者缺血性和出血性卒中的危险因素。


首都医科大学附属北京安贞医院 侯晓彤 译
河北省人民医院 杜全胜 审
哈尔滨医科大学附属第一医院 于凯江 述评
首都医科大学附属北京安贞医院 侯晓彤 述评
目的:静脉-静脉体外膜氧合(venovenous extracorporeal membrane oxygenation,V-V ECMO)患者常报道有脑卒中的发生,但其危险因素尚不明确。本研究将探究 ECMO 前和ECMO 期间患者缺血性和出血性卒中的危险因素。
设计:回顾性分析。
单位: 2013年~2019 年向体外生命支持组织报告数据的 366个ECMO 中心的数据。
患者:年龄大于18岁接受单次V-V ECMO辅助的患者。
干预:无。
测量与主要结果:在15,872例V-V ECMO患者中,812例(5.1%)患者发生至少1种急性脑损伤,脑损伤定义为缺血性卒中、出血性卒中或脑死亡。所有患者中,有215例(1.4%)患者发生缺血性卒中,484例(3.1%)患者发生出血性卒中。总住院死亡率为 36%,但缺血性或出血性卒中患者的死亡率更高(分别为 68% 和 73%)。在多元分析中,ECMO 辅助前pH[校正比值比(odds ratio,OR)= 0.10;95%CI,0.03~0.35;P < 0.001)、溶血(校正 OR = 2.27;95%CI,1.22~4.24;P = 0.010)、消化道出血(校正 OR = 2.01;95%CI,1.12~3.59;P = 0.019)和弥散性血管内凝血(校正 OR = 3.61;95%CI,1.51~8.66;P = 0.004)与缺血性卒中独立相关。ECMO 辅助前pH(校正 OR = 0.28;95%CI,0.12~0.65;P = 0.003)、ECMO 辅助前 PO2(校正 OR = 0.96;95%CI,0.93~0.99;P = 0.021)、消化道出血(校正 OR = 1.70;95%CI,1.15~2.51;P = 0.008)和肾脏替代治疗(校正 OR = 1.57;95%CI,1.22~2.02;P < 0.001)与出血性卒中独立相关。
结论:在体外生命支持组织注册的V-V ECMO患者中,约5%的患者发生急性脑损伤。当发生缺血性或出血性卒中时患者死亡率增加两倍。急性脑损伤与置管时的低pH、低氧血症以及凝血功能障碍等危险因素相关。为制定合适的预防和管理策略,有必要开展进一步研究来了解体外ECMO辅助前和ECMO辅助期间的危险因素以及急性脑损伤的发生时间。
关键词:脑死亡;脑损伤;外膜氧合;出血性卒中;缺血性脑卒中;V-V ECMO
静脉 - 静脉体外膜氧合(venovenous extracorporeal membrane oxygenation,V-V ECMO)是一种挽救生命的干预措施,可为难治严重急性呼吸衰竭患者提供呼 吸支持。近年来,V-V ECMO 的使用有所增加 [1],与接受传统机械通气的患者相比,V-V ECMO 降低了急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)患者的60天死亡率[2]。先前对体外生命支持组织(Extracorporeal Life Support Organization,ELSO)登记数据的分析表明,神经系统并发症或急性脑损伤(acute brain injury,ABI,定义为缺血性卒中、颅内出血和癫痫发作)的存在增加了ECMO导致功能不良和死亡的风险 [3]。在该研究中,7% 的V-V ECMO成人患者发生神经系统并发症,与颅内出血相关的死亡率为80%,缺血性卒中相关的死亡率为68%[3]。
通常,V-V ECMO 患者卒中的发生比静脉-动脉(venoarterial,V-A)ECMO 的患者少见,因为V-V ECMO 管道不涉及动脉循环,并且与 V-A ECMO 相比,V-V ECMO通常在抗凝较少甚至没有的情况下运行。但最近一项研究表明,无论 ECMO 的类型如何,ABI 的发生率是相同的 [4]。此外,当V-V ECMO 患者在插管后 24 小时内接受常规CT扫描时,有16%的患者出现出血性卒中 [5]。在接受死后神经病理学评估的患者中,有68%的ECMO 死亡者显示有ABI,这表明ABI的真实患病率可能比以前报道的要高 [6]。目前,有关ECMO相关的ABI患病率、风险因素、时机和管理在认识上还存在很多不足之处 [4,7]。了解 V-V ECMO 患者缺血性和出血性卒中的发生机制及危险因素,可以为指导预防和提供适当的治疗策略提供重要信息。
本研究的目的是识别接受V-V ECMO辅助的患者发生缺血性和出血性卒中的危险因素,更好地理解不同卒中亚型的潜在发生机制。我们假设缺血性卒中和出血性卒中具有不同的ECMO辅助前和ECMO辅助期间的危险因素。
材料和方法
研究设计和人群
ELSO注册数据库采取自愿上报的方式,收集来自全球366个中心的成人和儿童患者 ECMO的使用、适应症、并发症和结局等信息 [8]。注册表中存储的记录包括患者的人口统
计数据;临床特征;ECMO辅助前肺部诊断;ECMO辅助前和辅助期间的血流动力学和实验室数据;ECMO 辅助期间发 生的并发症,包括神经系统并发症;结局数据,例如出院存活率。根据《国际疾病分类》第9版和第10版的代码报告患者的诊断和病史。
本研究对 2013 年 ~2019 年的 ELSO 登记数据库进行回顾性分析。纳入≥ 18 岁仅接受过1次V-V ECMO辅助的呼吸衰竭患者进行分析。由于我们认为 ECMO 辅助期间的合并症可能会引起严重的混杂因素,因此我们排除了进行多次ECMO辅助的患者,以避免由于严重疾病导致分析过于复杂并产生偏倚。排除接受V-A ECMO辅助的患者。
数据收集和定义
对于本研究中的所有患者,我们从ELSO登记数据库中提取了以下信息:ECMO 辅助前的人口统计信息;ECMO辅助前的临床变量;心脏诊断;肺部诊断;化验结果;ECMO
辅助期间的临床变量,包括血液动力学数据和其他支持性心脏设备的使用;与 ECMO 相关的发病率和死亡率,包括神经系统并发症。在开始体外生命支持(extracorporeal life support,ECLS)前 6 小时内检测 ECLS 的血流动力学和动脉血气(arterial blood gas,ABG)值;如果数据库包含多个数值,那么我们选择最接近插管时间的数值。在 ECLS 开始后的18~30小时之间绘制24小时的ABG值。“ECMO 电路机械故障”变量包括:氧合器故障、接头破裂、滤血器血栓形成、环路血栓形成、管路更换、插管问题、环路进气、泵故障以及管路破裂。
神经系统并发症包括缺血性卒中、出血性卒中、脑死亡和癫痫发作。在ELSO数据库中,缺血性卒中定义为通过超声、CT或MRI 确定的中枢神经系统梗塞。出血性卒中定义为通过超声、CT 或 MRI 确定的中枢神经系统实质内或实质外出血。 ELSO数据库具有两个癫痫发作变量:通过临床评估确定的变量和通过脑电图确定的变量。我们将这两个变量合并为“癫痫发作”进行分析。尽管最近在ESLO数据库附录中添加了新的神经系统变量,包括“CNS 弥散性缺血”、“脑室内出血”和“进行神经外科手术”,但当前的分析中尚无这些变量。
此外,登记表中没有出血性卒中的亚型,例如脑出血、蛛网膜下腔出血和硬脑膜下血肿。这项研究由约翰·霍普金斯大学制度审查委员会进行了审查,因此不再需要批准。
统计学分析
通过不配对t检验、卡方检验或 Mann-Whitney U 检验(如适用)比较有无神经损伤(缺血性卒中、出血性卒中和脑死亡)的受试者的人口统计学和临床变量。正态分布的定量变量,结果表示为平均值±标准差(SD),非正态分布的定量变量则表示为中位数(四分位数);对于分类结果表示为比例。有序或分类数据表示为数字和百分比形式。P < 0.05 被认为有统计学差异。通过逻辑回归分析计算出具有 95%CI 的优势比(Odds ratio,OR)。我们仔细选择了具有生物学上合理关联或因果关系的相关临床变量纳入多元logistic回归分析,识别与缺血性卒中和出血性卒中相关的危险因素。通过计算赤池信息量准则(Akaike information criterion)来选择最佳模型。所有数据均使用 STATA 15(StataCorp,LLP,College Station,TX)进行分析。
结果
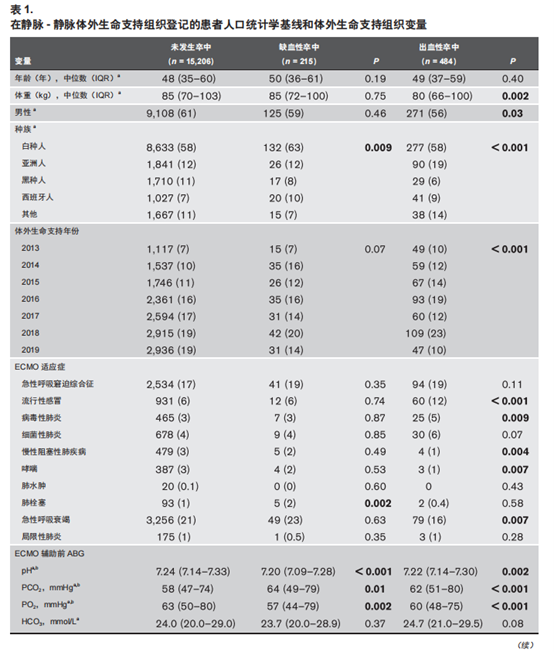
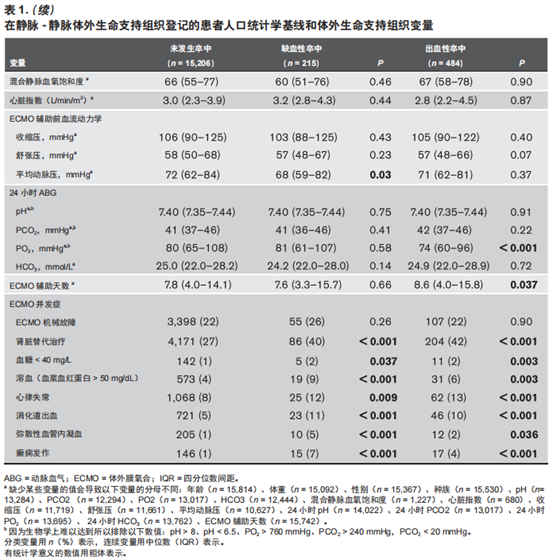
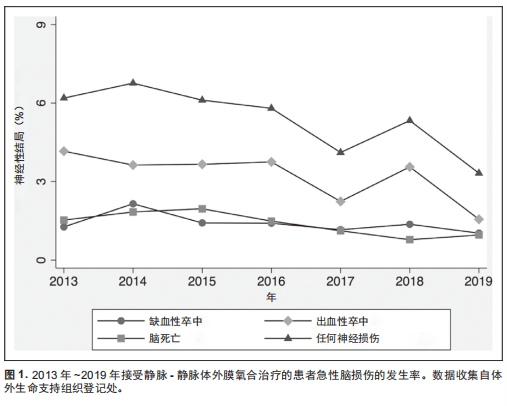
本研究共纳入15,872例接受V-V ECMO辅助的患者(中位年龄为49岁,男性患者占61%)。随着时间增加,2013年~2019 年V-V ECMO的使用从1,179例增至3,011例,在7年中增加2.5倍(表1)。在15,872例患者中,812例(5.1%)患者至少患有1 种类型的ABI,包括缺血性卒中、 出血性卒中或脑死亡(图1)。215例(1.4%)患者发生缺血性卒中,484例(3.1%)患者发生出血性卒中。据报道,204例(1.3%)患者发生脑死亡。尽管与V-V ECMO相关的缺血性卒中发生率在7年中保持稳定(P = 0.18),但出血性卒中和脑死亡的发生率却随时间下降(P < 0.001 和P = 0.002)(表1和补充表1,补充内容1,http://links. lww.com/CCM/F936)。2013年~2019年,V-V ECMO辅助期间的 ABI 发生率从 6.2% 下降至5.1%(图1)。所有ECMO 患者7 年内的死亡率为36%,在缺血性卒中发生的情况下死亡率增加至 68%,在出血性卒中发生的情况下死亡率增加至73%。在研究期间,随着时间的推移,总体死亡率保持稳定(38%~36%),ABI引起的死亡率也保持稳定(77%~74%)。
与ABI相关的单因素分析
在215例发生缺血性卒中的患者中,患者中位年龄为50岁,其中59%为男性。与未发生卒中的患者相比,表现出ECMO辅助前高 PCO2、ECMO 辅助前低 pH、低PO2和低平均动脉压的患者更可能发生缺血性卒中。在ECMO辅助期间,以下较高的ECMO并发症发生率与缺血性卒中相关:肾脏替代治疗(renal replacement therapy,RRT)、低血糖、溶血、心律不齐、消化道出血、弥散性血管内凝血(disseminated intravascular coagulation,DIC)和癫痫发作(表1)。
与未发生卒中的患者相比,484例出血性卒中患者(中位年龄49岁,男性56%)的体重更低,ECMO辅助前的PO2较低,ECMO 辅助前的 PCO2 较高,ECMO辅助期间的pH 和 PO2 较低,ECMO 辅助的持续时间更长,ECMO 并发症(包括 RRT、低血糖、溶血、心律不齐、消化道出血、DIC和癫痫发作)的发生率更高(表1)。
与没有脑死亡的患者相比,脑死亡的患者更年轻,ECMO辅助前的pH 和HCO3更低,ECMO 辅助前的 PCO2 较高,ECMO 辅助前的血压值较低。与没有脑死亡的患者相比,脑死亡的患者 ECMO 辅助期间的pH和HCO3较低,PCO2 较高,ECMO辅助的时间更短,包括 RRT、DIC 和癫痫发作的ECMO并发症发生率更高(补充表1,补充内容 1,http:// links.lww.com/CCM/F936)。
发生缺血性卒中患者的ECMO辅助前PO2值低于未发生卒中的患者(57 vs 63 mmHg,P = 0.002)。同样,出血性卒中患者的 ECMO 辅助前PO2值也低于未发生卒中者(60 vs 63mmHg,P < 0.001)。补充图1(补充内容2,http://links. lww.com/CCM/F937;图例, 补充数字内容3,http://links. lww.com/CCM/F938)表明,出血性卒中患者中低氧血症者要
多于未发生卒中的患者(补充图 1B,补充数字内容 2,http:// links.lww.com/CCM/F937)。即使在24小时的 ECMO 辅助下,发生出血性卒中患者的PO2值仍低于未发生卒中患者(74 vs 80 mmHg,P < 0.001)。
与ABI相关的多因素分析
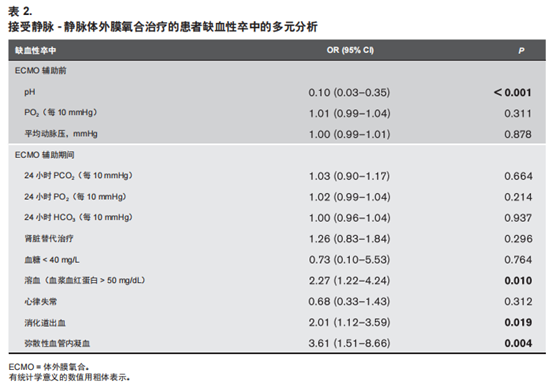
多因素分析中,ECMO辅助前的pH[ 校正OR(adjustedOR,aOR)= 0.10;95%CI,0.03~0.35;P < 0.001]、溶血(aOR = 2.27;95%CI,1.22~4.24;P = 0.010)、消化道出血(aOR = 2.01;95%CI,1.13~3.59;P = 0.019)和DIC(aOR = 3.61;95%CI,1.51~8.66;P = 0.004)与缺血性卒中独立相关(表2)。ECMO 辅助前 pH(aOR = 0.28;95%CI,0.12~0.65;P = 0.003)、ECMO 辅助前 PO2 (aOR = 0.96;95%CI,0.93~0.99;P = 0.021)、消化道出血(aOR = 1.70;95%CI = 1.15~2.51;P = 0.00和 RRT(aOR = 1.57;95%CI = 1.22~2.02;P <0.001)与出血性卒中独立相关(表3)。

讨论
发生率和死亡率
我们对ELSO登记中心中15,872例V-V ECMO 患者的分析表明,大约5%的患者至少患有一种类型的ABI,即缺血性卒中、出血性卒中或脑死亡。在研究期间,V-V ECMO辅助期间报道的 ABI 发生率稳定在 5%~6%。尽管V-V ECMO患者的总体死亡率为36%,但毫不意外如先前报道的那样[3,4,7],当发生缺血性卒中或出血性卒中时患者死亡率增加1倍。与缺血性或出血 性卒中相关的死亡率在 7 年内 保持稳定。值得注意的是,在ELSO 数据库中观察到的缺血性卒中和出血性卒中的发生率(分别为 1.4% 和 3.1%)低于先前文献中报道的发生率(缺血性卒中为 4%~14%,出血性卒中为 4%~19%)[4,5,9- 13]。ELSO 数据是自愿填报的,并没有对神经系统诊断进行修正,因此本研究可能低估了卒中的发生率。并且在登记册中,诊断卒中并不强制要求有脑部CT扫描。此外,CT扫描对于检测早期脑缺血变化和后颅窝缺血并不敏感。更引人注目的是,最近的两项脑解剖研究发现,69%~90% 的ECMO 死亡者在死后病理检查中发现有 ABI[6,14],这表明ABI 的真实患病率可能比临床观察研究中报道的要高得多。更好地了解 ECMO 的神经后遗症并及时诊断,建立神经系
统监测常规以及系统性监护是非常重要的,可以为患者提供适当的治疗干预[7,15,16]。
缺血性脑卒中
V-V ECMO患者缺血性卒中发生的危险因素和机制尚不清楚[3,9,10]。重症疾病与房颤等心律不齐密切相关,而房颤是一种已知的导致栓塞性卒中的原因,另外还有高凝状态及抗凝水平难以控制[4,17,18]。我们的结果表明,心律不齐并不是缺血性卒中的独立危险因素。其它与 V-V ECMO 相关的生物学原因可能包括通过卵圆孔未闭的环路血栓导致的脑栓塞以及大脑静脉窦血栓的形成(cerebral venous sinus thrombosis,CVST)[4]。如果血栓进入颅内,使用颈内静脉插管是 CVST 的已知危险因素,使用目前常用的双腔右颈内静脉静脉导管可能会增加这种危险。但其内径明显大于过去常规使用的单腔插管 [4]。有趣的是,在撤除 ECMO 股静脉、颈静脉插管后4天内对患者进CT扫描,发现 53%(42/79)的患者出现与插管相关的颈静脉深静脉血栓形成 [19]。ELSO 数据库未收集有关CVST的信息,因此,我们无法评估其与 ABI 的相关关系。
我们确定了与缺血性卒中相关的四个独立变量,即ECMO辅助前较低的 pH 和 ECMO的3个并发症(溶血、消化道出血和DIC)。这些发现可能帮助我们更好地了解接受 V-V ECMO 辅助的患者发生缺血性卒中的时机和类型。缺血性卒中组患者的 ECMO 辅助前 pH 值较低表明,在插管前出现严重的难治性呼吸衰竭以及血液动力学不稳定可能是缺血性卒中发生的原因。ELSO 注册数据并未区分卒中的亚型,这限制了我们对全脑缺血、缺氧性脑损伤或分水岭脑梗与其他脑梗形式进行区分,例如在 TOAST(Trial of Org 10172 in Acute Stroke Treatment)标准中定义的大动脉粥样硬化、小血管闭塞和心源性栓塞[20]。与 ECMO 辅助前的低氧呼吸衰竭导致的全脑缺血不同的是,溶血和DIC作为ECMO辅助期间的独立风险因素可能直接导致栓塞性卒中,与微血管病相关[21]。值得注意的是,溶血和亚临床泵血栓形成(可能导致我们观察到的血浆游离血红蛋白升高)是左心辅助装备人群缺血性脑梗死的已知危险因素[22]。相反,消化道出血更可能象征着凝血功能紊乱,或者意味着危重疾病并发缺血性卒中,引起应激性溃疡。
出血性卒中
我们发现了与出血性卒中相关的四个独立变量,包括较低的ECMO辅助前pH、PO2 和两个ECMO并发症(RRT和消化道出血)(表3)。机械循环支持设备如LVAD和 ECMO,会引起血小板功能障碍和内皮细胞功能障碍,从而导致继发的获得性血管性血友病综合征(VIII 因子缺乏症)——一项已知的出血危险因素[23-25]。我们发现RRT可以增加出血风险,这与之前血小板减少和肾功能衰竭是出血性卒中的危险因素的研究报道一致。我们还观察到出血性卒中组患者的 ECMO 辅助前pH和PO2值均较低 [ 表1; 补充图1,补充内容2,http://links.lww.com/CCM/F937(图例,补充内容 3,http://links.lww.com/CCM/F938)]。 两 组之间pH和PO2的中位数绝对差值(pH 为0.02,PO2 为3 mmHg)(表1)没有临床意义。然而,有人认为出血性卒中发生在ECMO插管期间,并伴有难治性缺氧和血液动力学不稳定。在出血性卒中组中,更多的 RRT 也会导致更严重的血液动力学不稳定。最近的观察性研究支持了这一推测,研究报告显示,V-V ECMO患者接受了早期常规CT扫描,这部分患者报道的出血性卒中发生率为 16%[5], 且在体外循环心肺复苏患者中的发生率为 10%[27]。考虑到这些有关CMO期出血性卒中的最新数据,我们提出了有关V-V ECMO出血性卒中潜在机制的两个假设。第一, 早期出血可能继发于顽固呼吸衰竭时新鲜的脑组织缺血[28],在ECMO置管应用负荷量肝素并维持抗凝时发生。第二,出血性卒中可能发生在重度ARDS患者中,与CMO无关。Lockie[5]报道,需要机械通气的ARDS患者中约有8%发生出血性卒中,这部分患者未接触过肝素或ECMO循环。然而,这些患者出血性卒中的发生率是接受V-V ECMO 辅助患者出血性卒中发生率的两倍(16%)[5]。同样,危重病和严重呼吸衰竭的患者可能出现颅内微出血[29,30]; 因此,许多出血性卒中可能发生在 ECMO运行之前。需要进行进一步的研究来了解严重的缺氧性呼吸衰竭与导致颅内微出血和大出血的严重疾病之间的关系,以及其与抗凝强度之间的关系。
局限性
本研究的主要局限性在于它是一项回顾性分析,并且ELSO登记中心缺少诊断缺血性和出血性卒中的几个重要解释变量,包括抗凝数据、房颤的发生、卵圆孔未闭、血小板计数以及其他卒中的危险因素。我们也无法测量低氧血症 / 酸中毒的暴露时间,因为每个患者ECMO辅助前和ECMO期间只有一个ABG数据点。我们可能低估了 ELSO 登记中心中 ABI的发生率,因为登记数据库的条目是自愿报告的,并且没有对神经系统诊断在上报前或者上报后进行统一修正。此外,我们尚不清楚患者何时进行脑部CT检查、CT检查的适应症以及脑死亡的标准。由于本研究为回顾性,卒中时间和协变量具有不确定性,因此我们对ABI的多元logistic回归模型的发现仅能表明这些因素具有相关性,并不意味着这些因素具有预测性。需要进一步评估生理变量(例如PO2和pH)中一些微小差异的临床相关性,并且这种差异可能是由于分析的数值太多而偶然出现的。本研究的优势在于样本量大和统计效力高。ELSO登记中心是最大的国际 ECMO 数据库,为评估大量患者中每种类型ABI的发生率、死亡率和危险因素提供了独一无二的可能。
结论
在ELSO注册数据库的V-V ECMO 患者中, 约有5%的患者发生 ABI。发生缺血性和出血性卒中患者的死亡率(~70%)高于未发生卒中的患者。随着ECMO的使用呈指数增加,未来的研究应针对使用神经学监测手段来及早识别并发症的发生,并制订针对性管理策略,尤其是关于抗凝时机和强度。
1 Division of Neuroscience Critical Care, Department of Neurology, Johns Hopkins University School of Medicine, Baltimore,MD.
2 Division of Neuroscience Critical Care, Department of Anesthesiology and Critical Care Medicine, Johns Hopkins University School of Medicine, Baltimore, MD.
3 Division of Cardiac Surgery, Cardiovascular Surgical Intensive Care, Department of Surgery, Heart and Vascular Institute, Johns Hopkins University School of Medicine, Baltimore, MD.
4 Cardiothoracic Surgery Department, Maastricht University Medical Centre(MUMC), Cardiovascular Research Institute Maastricht(CARIM),Maastricht,the Netherlands.
5 Division of Anesthesiology, Intensive Care and Emergency Medicine, Spedali Civili University, Affiliated Hospital of Brescia, Brescia, Italy.
6 Extracorporeal Life Support Organization(ELSO), Ann Arbor,MI.
7 Division of Thoracic Surgery, Department of Surgery, Heart and Vascular Institute, Johns Hopkins University School of Medicine, Baltimore, MD.
Drs.Ziai and Whitman contributed equally.
Supplemental digital content is available for this article. Direct URL citations appear in the printed text and are provided in the
HTML and PDF versions of this article on the journal's website (http://journals./ww.com/ccmjournal).
Dr. Cho receives a grant from the Extracorporeal Life support Organization. Dr. Lorusso is a consultant for Medtronic and LivaNova and an advisory board member for EUROSETS. All honoraria are paid to Maastricht University for research funding. Dr. Geocadin is supported, in part, by the National Institute of Health(NIH)Grants UG3 HL145269 and RO1 HL071568 and medico-legal consulting, and unrestricted fund from the Wenzel Family Foundation. He received support for article research from the NIH. Dr. Ziai is supported by the NIH and receives consulting fees from C.R. Bard and Portola outside of the area of work com-mented on here. The remaining authors have disclosed that they do not have any potential conflicts of interest.
Address requests for reprints to: Sung-Min Cho, DO, MHS, Division of Neuroscience Critical Care, Department of Neurology, Johns Hopkins University School of Medicine, Baltimore, MD, and Division of Neuroscience Critical Care, Department of Anesthesiology and Critical Care Medicine,Johns Hopkins University School of Medicine, Baltimore, MD. E-mail:csungmi1@jhmi.edu
参考文献
1. McCarthy FH, McDermott KM, Kini V, et al: Trends in U.S.extracorporeal membrane oxygenation use and outcomes:2002-2012. Semin Thorac Cardiovasc Surg 2015;27:81-88
2. 2. Munshi L, Walkey A, Goligher E, et al: Venovenous extracor-poreal membrane oxygenation for acute respiratory distress syndrome: A systematic review and meta-analysis. Lancet Respir Med 2019;7:163-172
3. Lorusso R, Gelsomino S,Parise O, et al: Neurologic injury inadults supported with veno-venous extracorporeal membrane oxygenation for respiratory failure: Findings from the extracor-poreal life support organization database. Crit Care Med 2017;45:1389-1397
4. Cho SM, Farrokh S, Whitman G, et al: Neurocritical care for extracorporeal membrane oxygenation patients. Crit Care Med 201947:1773-1781
5. Lockie CJA, Gillon SA, Barrett NA, et al: Severe respiratory failure, extracorporeal membrane oxygenation, and intracranial hemorrhage. Crit Care Med 2017; 45:1642-1649
6. Cho SM, Geocadin RG, Caturegli G, et al: Understanding char-acteristics of acute brain injury in adult extracorporeal mem-brane oxygenation: An autopsy study. Crit Care Med 2020;48:e532-e536
7. Cho SM, Ziai W, Mayasi Y, et al: Noninvasive neurological monitoring in extracorporeal membrane oxygenation. ASAIO J 201966:388-393
8. Thiagarajan RR, Barbaro RP, Rycus PT, et al; ELSO Member Centers: Extracorporeal life support organization registry inter-national report 2016.ASAIO J2017;63:60-67
9. Luyt CE, Brechot N, Demondion P, et al: Brain injury during
venovenous extracorporeal membrane oxygenation. Intensive Care Med 2016;42:897-907
10. Kon ZN, Bittle GJ, Pasrija C, et al: Venovenous versus venoar-terial extracorporeal membrane oxygenation for adult patients with acute respiratory distress syndrome requiring precannu-lation hemodynamic support: A review of the ELSO registry. Ann Thorac Surg 2017;104:645-649
11. Fletcher-Sandersjoo A, Bartek J Jr, Thelin EP, et al: Predictorsof intracranial hemorrhage in adult patients on extracorpo-real membrane oxygenation: An observational cohort study. J Intensive Care 2017;5:27
12. Kasirajan V, Smedira NG, McCarthy JF, et al: Risk factors for intracranial hemorrhage in adults on extracorporeal membrane oxygenation. Eur J Cardliothorac Surg 1999;15:508-514
13. Mazzeffi M,Kon Z,Menaker J,et al:Large dual-lumen extracor-poreal membrane oxygenation cannulas are associated with more intracranial hemorrhage. ASAIO J2019;65:674-677
14. Mateen FJ, Muralidharan R, Shinohara RT, et al: Neurological injury in adults treated with extracorporeal membrane oxygen-ation.Arch Neuro/2011;68:1543-1549
15. Cho SM, Choi CW, Whitman G, et al: Neurophysiological find-ings and brain injury pattern in patients on ECMO. Clin EEGG Neurosci2019:1550059419892757
16. Cho SM, Ziai W, Geocadin R, et al: Arterial-sided oxygenatorclot and transcranial doppler ultrasound emboli in venoarte-rial extracorporeal membrane oxygenation. Ann Thorac Surg 2019107:326-327
17. Clayton B, Ball S, Read J, et al: Risk of thromboembolism in patients developing critical illness-associated atrial fibrillation. Clin Med (Lond) 2018; 18:282-287
18. Ryu JA, Bang OY, Suh GY, et al: Ischemic stroke in critically ill patients with malignancy. PLoS One 2016; 11:e0146836
19. Parzy G, Daviet F, Persico N, et al: Prevalence and risk factors for thrombotic complications following venovenous extracor-poreal membrane oxygenation: A CT scan study. Crit Care Med 2020;48:192-199
20. Adams HP Jr, Bendixen BH, Kappelle LJ, et al: Classification of subtype of acute ischemic stroke. Definitions for use in a multicenter clinical trial. TOAST. Trial of Org 10172 in acute stroke treatment. Stroke 1993;24:35-41
21. Fagniez O, Tertian G, Dreyfus M, et al: Hematological disorders related cerebral infarctions are mostly multifocal. J Neurol Sci 2011;304:87-92
22. Cho SM, Hassett C, Rice CJ, et al: What causes LVAD-associated ischemic stroke? Surgery, pump thrombosis, antithrombotics, and infectionsa. ASAIO J 2019; 65:775-780
23. Kalbhenn J, Schlagenhauf A, Rosenfelder S, et al: Acquired von Willebrand syndrome and impaired platelet function during venovenous extracorporeal membrane oxygenation:Rapid onset and fast recovery. J Heart Lung Transplant 2018;37:985-991
24. Kalbhenn J, Schmidt R, Nakamura L, et al: Early diagnosis of acquired von Willebrand syndrome (AVWS) is elementary for clinical practice in patients treated with ECMO therapy. J Atheroscler Thromb 2015;22:265-271
25. Cho SM, Lee T, Starling RC, et al: The impact of infection and elevated INR in LVAD-associated intracranial hemorrhage: A case-crossover study. ASAIO J2019; 65:545-549
26. Guennec LL, Cholet C, Schmidt M, et al: Brain injury during veno-arterial extracorporeal membrane oxygenation. Ann Intensive Care 2017;7:8
27. Zotzmann V,Rilinger J,Lang CN,et al:Early full-body computed tomography in patients after extracorporeal cardiopulmonary resuscitation(eCPR).Resuscitation2020;146:149-154 28. Zhang J, Yang Y, Sun H, et al: Hemorrhagic transformation after cerebral infarction: Current concepts and challenges. Ann Trans/Med 2014;2:81
29. Riech S, Kallenberg K, Moerer O, et al: The pattern of brain microhemorrhages after severe lung failure resembles the one seen in high-altitude cerebral edema. Crit Care Med 2015;43:e386-e389
30. Fanou EM, Coutinho JM, Shannon P, et al: Critical illness-asso-ciated cerebral microbleeds. Stroke 2017;48:1085-1087
专家述评
于凯江 哈尔滨医科大学附属第一医院
随着V-VECMO技术的推广与普及,越来越多的ARDS及重症肺炎患者应VVECMO进行治疗。应用VVECMO也确实降低了ARDS患者的60天死亡率。特别是在新冠肺炎流行期间,应用VVECMO抢救及治疗了一批危重患者。但向文中提到一样,其神经系统的并发症发病率很高,并且可能引起不良的临床结局,增加患者死亡率。本文根据体外生命支持组织(ELSO)注册表数据的分析表明神经系统并发症或急性脑损伤的存在增加了不良结局和 ECMO 致死的风险。在该研究中,有5%的V-V ECMO患者合并了神经系统并发症,在本次ELSO数据库中观察到的缺血性卒中和出血性卒中的发生率(分别1.4%和3.1%)低于先前文献中的报道,总体住院死亡率为 36%,缺血性或出血性卒中的死亡率更高(分别为68%和73%)。此外,根据注册表中的 信息,提取了一些变量判断是否与卒中相关,但这些变量仅限于已登记的信息。在相关因素的分析中,缺少一些我们更加关注的变量,例如抗凝的方法、抗凝剂的种类,抗凝剂的剂量是否和卒中风险直接相关。此外对于出血性卒中及缺血性卒中,并未按照疾病种类亚型进行区分,限制了分析不同类型疾病对死亡率的影响。由于数据的限制及各地区上报数据的质量问题,以及治疗中心的管理V-VECMO能力和水平的不同,可能造成发病率及死亡率测算的不准确。
侯晓彤 首都医科大学附属北京安贞医院
Sung-Min Cho等 [1] 近期在 Critical Care Medicine 杂志利用国际体外生命支持组织(Extracorporeal Life Support Organization,ELSO)的注册数据,对静脉-静脉体外膜氧合(V-V ECMO)成人患者的脑卒中发生情况进行了分析。研究纳入了2013年~2019年7年之间的 ELSO注册数据,共有来自全球 366 个 ECMO 中心 15,872 例 V-V ECMO 成人患者,缺血性脑卒中发生率为 1.4%,出血性脑卒中发生率为 3.1%,住院死亡率分别为 68% 和 73%,要高于整体人群。研究还对脑卒中的危险因素进行了分析,缺血性脑卒中的危险因素包括上机前的低 pH 值、溶血、消化道出血及弥散性血管内凝血(DIC)。而上机前的低 pH 与低氧分压、消化道出血及肾替代治疗则是出血性脑卒中的危险因素。
本研究的病例数量庞大,回顾性描述、分析了注册数据库中V-V ECMO成人患者卒中并发症。虽然存在注册研究的诸多局限性,例如 ELSO 注册数据库为自愿上报,且注册数据库未对卒中诊断进行严格诊断要求,可能会低估卒中并发症的发生率,但与2016年法国一项单中心研究结果并未相差过多,该研究连续纳入了 135 例 V-V ECMO 患者,其中缺血性卒中发生率为 2%,出血性卒中发生率为 7.5% [2]。另外,人们以往认为V-V ECMO不涉及循环辅助,神经系统并发症应低于静脉 - 动脉 ECMO(V-A ECMO)患者,但先前一项 Roberto Lorusso等 [3]发表的4,522 例 V-A ECMO神经系统并发症的ELSO注册研究显示,V-A ECMO患者的缺血性卒中发生率为3.6%,而出血性卒中发生率为1.8%。这说明虽然 V-V ECMO 的氧合回输血只进人静脉系统,可以应用低剂量的抗凝,但卒中发生比例并不低于 V-A ECMO,应引起临床上的足够重视。
Roberto Lorusso等[4] 在2017年就对 1992年~2015 年 ELSO 注册数据库中的4,988例V-V ECMO 成人患者进行分析,但在危险因素分析时并未区分神经系统损伤的种类,以任意一种神经系统损伤作为分析终点(包括颅内出血、脑死亡、卒中与癫痫发作),发现 ECMO 前的心脏骤停、持续血液滤过治疗与 ECMO 期间的高胆红素血症为 V-V ECMO 患者神经系统损伤的危险因素,临床意义有限,特别是 ECMO 前的心脏骤停可能会与卒中和脑死亡关联过强,无法对神经系统损伤的预防起到提示。Sung-Min Cho 等 [1] 则对缺血性卒中与出血性卒中分别进行讨论,除了ECMO前的危重状态以外(pH),ECMO 期间的溶血与凝血功能紊乱(消化道出血、DIC)可能与缺血性卒中直接相关,对患者的临床管理具有一定提示价值
Sung-Min Cho等 [1]的研究仍属于对前瞻性注册数据的回顾性分析,因此很多卒中相关的临床数据仍然未能获取,特别是卒中发生的确切时间、部位、严重程度、功能影响及远期预后,这可以更好的理解ECMO患者卒中发生的病理生理学机制。与卒中相关的具体临床信息也应在进一步研究中获取,例如出凝血状态、抗凝方案、血制品输注等,使后续研究可以提出ECMO患者管理的改进方案。
最后应再次强调该研究提示给我们的,V-V ECMO成人患者的卒中发生率并不低于 V-A ECMO,并且并发卒中患者的住院死亡率明显升高,关注患者的出凝血管理与优化抗凝方案对于患者卒中的预防是至关重要的。
参考文献
1. Cho SM, Canner J, Caturegli G, Choi CW, Etchill E, Giuliano K,Chiarini G,Calligy K, Rycus P,Lorusso R et al: Risk Factors of Ischemic and Hemorrhagic Strokes During Venovenous Extracorporeal Membrane Oxygenation: Analysis of Data From the Extracorporeal Life Support Organization Registry. CritCare Med 2021,49(1):91-101.
2.Luyt CE,Brechot N,Demondion P,Jovanovic T,Hekimian G,Lebreton G,NieszkowskaA, Schmidt M, Trouillet JL,Leprince P et al:Brain injury during venovenous extracorporeal membraane oxygenation.Intensive Care Med 2016,42(5):897-907.
3.Lorusso R,Barili F,Mauro MD,Gelsomino S,Parise O,Rycus PT,Maessen J,Mueller T,Muellenbach R,Belohlavek J et al:In-Hospital Neurologic Complications in Adult Patients Undergoing Venoarterial Extracorporeal Membrane Oxygenation: Results From the Extracorporeal Life Support Organization Registry.Crit Care Med 2016,44(10):e964-972.
4.Lorusso R,Gelsomino S,Parise O,Di Mauro M,Barili F,Geskes G, Vizzardi E,Rycus PT,Muellenbach R, Mueller T et al:Neurologic Injury in Adults Supported With Veno-Venous Extracorporeal Membrane Oxygenation for Respiratory Failure: Findings From the Extracorporeal Life Support Organization Dattabase.CritCare Med 2017,45(8):1389-1397.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言