内皮细胞在新冠状病毒大流行中的作用
2021-11-18 刘少飞 MedSci原创
2019 年新型冠状病毒,被称为严重急性呼吸系统综合症冠状病毒2(SARS-CoV-2)或2019年冠状病毒病(COVID-19),正在引起全球大流行。该研究探讨内皮功能障碍在其中的作用。
新型冠状病毒(SARS-CoV-2)主要影响上呼吸道和下呼吸道,并增加各种非肺部后果的风险,其中最严重且可能致命的是心血管问题。数据显示,几乎三分之一的中度或重度 COVID-19 患者有既往心血管疾病,如糖尿病、肥胖症、高血压、心力衰竭或冠状动脉疾病。SARS-CoV2 导致多种细胞类型(主要是内皮细胞)的过度炎症、缺氧、细胞凋亡和肾素-血管紧张素系统失衡。与 COVID-19 相关的严重内皮功能障碍可能是器官灌注受损的原因,这可能导致急性心肌损伤、肾功能衰竭和导致血栓栓塞事件的促凝状态。
动脉、静脉和毛细血管的细胞内衬由血管内皮形成,血管内皮是内皮细胞的连续单层。它以类似于内分泌器官的机制作为组织和血液之间的屏障。通过与血液成分和其他循环细胞的动态相互作用,内皮与许多病理过程密切相关。这种大型内分泌器官的各种活动对于在生理环境下维持止血平衡至关重要。血管内皮是血液和组织之间的关键界面。内皮表现出许多对体内平衡有重要贡献的特性。它显示了一个严格调控的功能调色板,这些功能控制血管舒缩、血管通透性、炎症控制、氧化应激和结构定义。在过去的冠状病毒感染的病理生理学中,内皮细胞已被破坏,无论是直接通过信号效应,还是通过增加促炎介质合成和随后的凝血级联失调。一般来说,内皮功能障碍是由以下原因引起的:(1) 衰老,(2) 性激素及其随年龄增长而减少,(3) 活性氧 (ROS),(4) 循环内皮微粒与祖细胞 (EMP) 的比例增加/PCs) 和 (5) 促炎状态。
细胞因子风暴对内皮细胞的影响
SARS-CoV2 导致多种细胞类型(包括巨噬细胞、II 型肺泡细胞、T 细胞和内皮细胞)的过度炎症、缺氧、细胞凋亡和肾素-血管紧张素系统失衡。内皮渗漏、细胞死亡、全身炎症和血栓形成都可能由大量促炎细胞因子/趋化因子引起。具有高水平 Ang-II 的内皮具有促炎和促凝特性。由于线粒体ROS产生、细胞内酸中毒、细胞信号通路激活和血液粘度增加,ARDS诱导的缺氧可能导致内皮功能障碍。内皮功能障碍和血栓形成因免疫反应失调、高细胞因子血症、RAS 失衡、补体激活和低氧血症而恶化。
COVID-19 内皮功能障碍
几乎所有器官的内皮细胞、平滑肌细胞和血管周围周细胞上都存在 ACE2,这表明 SARS-CoV-2 一旦进入循环系统就很容易在全身传播。全身性高血压、糖尿病和肥胖,其中内皮功能障碍是已知的主要因素,是 COVID-19 患者中最常见的合并症,与较差的预后和更高的死亡率有关 。内皮细胞中也显示了病毒包涵体结构,表明这些细胞已被病毒直接感染;这些标本的病理检查显示粘膜下动脉内皮炎 。
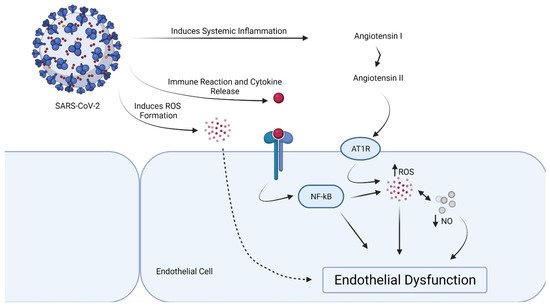
RAS 和内皮功能障碍的局部失调
没有已知合并症的 COVID-19 个体的粗死亡率为 0.9%,而心血管疾病患者为 10.5%,糖尿病患者为 7.3%。此外,这些合并症似乎与年龄密切相关,这似乎是 COVID-19 相关死亡率的最有力预测指标。与较低年龄组相比,45 岁及以上的人更有可能死于 COVID-19。随着年龄的增长,脉管系统会发生复杂的结构和功能变化,导致内皮细胞和平滑肌细胞功能障碍。随着年龄的增长,内皮细胞产生 NO 和对激动剂和机械刺激作出反应的能力显着降低。鉴于内皮功能障碍在高血压、心血管疾病、糖尿病和肥胖症的发病机制中的重要性,调查内皮功能障碍在 COVID-19 病因学中的参与可能会提供重要的见解。此外,新的证据表明 SARS-CoV-2 可能会导致血管损伤,这意味着预先存在的内皮功能障碍加上 SARS 直接的 CoV-2 对血管系统的攻击可能解释了 COVID-19 合并症患者死亡率增加的原因。
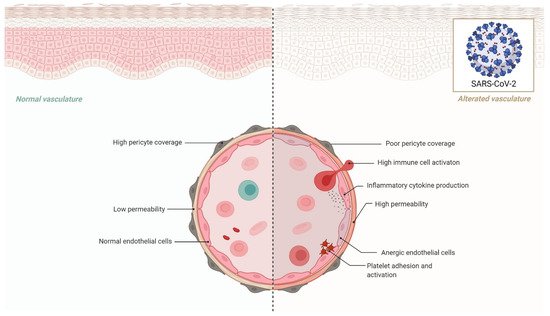
心力衰竭和 COVID-19
在各种方面,心血管疾病 (CVD) 可能与对 COVID-19 的易感性增加和/或后果的严重性有关。患有预先存在的心力衰竭 (HF) 或 HF 危险因素的受试者更可能因任何病毒感染而发展为 HF。为了进入上皮,SARS-CoV-2利用由肺上皮细胞产生的ACE2作为其刺突蛋白的受体结合域。低氧性呼吸衰竭和 ARDS 可能会增加 COVID-19 感染患者的肺血管收缩和间质水肿,增加没有预先存在肺部疾病的个体的肺动脉高压 。ARDS 引起的肺压进一步升高可能会损害已经患有双心室衰竭的个体的右心室功能。晚期 HF 患者,尤其是那些长期接受 LVAD 支持的患者,根据峰值 VO2 评估的功能能力显着降低,并且在生理压力下增加心输出量的能力受损。
未来展望
COVID-19 患者经常有多个器官系统的临床表现,尤其是肺、脑、心脏、肾脏和脉管系统,并且已经有一些 COVID-19 后表现的证据。考虑到所有现有证据,我们可以得出结论,内皮功能障碍在 COVID-19 的发病机制中起着重要作用,特别是对于已有合并症如糖尿病、肥胖症、高血压或心血管疾病的患者。我们知道,这些患者在感染 SARS-CoV-2 时出现更严重症状和并发症的风险更高。此外,这些合并症的存在与 COVID-19 期间对重症监护和相关死亡率的更大需求有关。大量研究表明,广泛使用的他汀类药物、肾素-血管紧张素系统抑制剂或 β 受体阻滞剂可改善内皮功能和器官相关并发症,尽管治疗持续时间是一个重要因素。因此,我们不能排除这些药物可能有助于预防 SARS-CoV2 感染的一些并发症,只要这些治疗没有禁忌症。
文献出处:
Ionescu M, Stoian AP, Rizzo M, Serban D, Nuzzo D, Mazilu L, Suceveanu AI, Dascalu AM, Parepa IR. The Role of Endothelium in COVID-19. Int J Mol Sci. 2021 Nov 3;22(21):11920. doi: 10.3390/ijms222111920. PMID: 34769350; PMCID: PMC8584762.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言