蛋白丢失性胃肠病2例
2011-07-12 MedSci原创 MedSci原创
来源:中国医学论坛报 病例1 患者女性,44岁,因“间断双下肢水肿4年,加重4个月”入院。 患者4年前无明显诱因出现双下肢可凹性水肿,范围最高至小腿,未予特殊处理,半个月后自行消退。2年前,患者无明显诱因再次出现双下肢小腿以下水肿,逐渐加重,严重时至腰部、外阴水肿,并伴眼睑水肿,体重增加约10 kg,伴乏力、尿少。就诊于当地医院,查肝功能示血清白蛋白(ALB)23.
来源:中国医学论坛报

病例1
患者女性,44岁,因“间断双下肢水肿4年,加重4个月”入院。
患者4年前无明显诱因出现双下肢可凹性水肿,范围最高至小腿,未予特殊处理,半个月后自行消退。2年前,患者无明显诱因再次出现双下肢小腿以下水肿,逐渐加重,严重时至腰部、外阴水肿,并伴眼睑水肿,体重增加约10 kg,伴乏力、尿少。就诊于当地医院,查肝功能示血清白蛋白(ALB)23.9 g/L,余正常;尿蛋白(-);在接受补充白蛋白及利尿等治疗后,患者水肿症状明显好转,但复查血ALB无好转。此后反复因双下肢水肿就诊于外院,查ALB最低10 g/L,间断补充蛋白及利尿治疗,为进一步诊治入我院。
发病以来,患者精神可,食欲好,进食不少,无明显血尿及泡沫尿;大便1次/日,粪便中无黏液、脓血或油滴。
既往史:4年前发现乙肝表面抗原(HBsAg)、e抗体(HBeAb)及核心抗体(HBcAb)均(+),肝功能正常。
入院查体:叩诊肩胛下角线双肺下界位于第9肋间,肠鸣音活跃,8次/分。双下肢轻度可凹性水肿。
入院诊断:低蛋白血症 原因待查。
病例2
患者女性,69岁,因“双下肢水肿伴间断稀便37年,加重半年”入院。
患者自37年前无明显诱因出现双内踝部可凹性水肿,无明显血尿、泡沫尿;间断出现稀便,为黄褐色,无明显黑便、脓血便。患者症状持续存在,双下肢水肿范围略扩大,间断有腹泻。曾查血发现“蛋白低”,具体不详。为进一步诊治入我院。
发病以来,患者食欲可,主食为麦类与大米,食肉类较少,精神、睡眠可。
既往史:12年前发现血糖高,未规律诊治。
家族史:母曾有双下肢及面部水肿,死于肺炎。
入院查体:双下肺呼吸音稍低,双下肢可凹性水肿明显,至小腿,以右侧为著。
入院诊断:低蛋白血症 原因待查。
Step 1 低蛋白血症可能的原因?
低蛋白血症在临床上很常见,原因有多种,蛋白质摄入不足、消化吸收不良、肝脏合成功能下降、蛋白丢失过多及蛋白消耗过多等均可导致低蛋白血症。
病例1一般情况好,进食情况好,无腹泻和脂肪泻,无明确摄入不足、吸收不良或消耗过多的因素。应着重从肝脏合成功能下降和蛋白丢失过多方面进行分析。
病例2有多年稀便史,应考虑有无消化吸收不良可能,同时也应考虑有无蛋白丢失过多可能。
造成长期大量蛋白丢失的原因包括:① 肾脏丢失蛋白,患肾病综合征、狼疮性肾炎及糖尿病肾病等肾脏病变者可有大量蛋白尿,引起低蛋白血症;② 浆膜腔丢失蛋白,反复胸腹腔积液及终末期肾病患者行腹膜透析治疗时可经浆膜腔丢失蛋白;③ 蛋白丢失性胃肠病,在除外上述情况后,须重点考虑经胃肠道丢失蛋白,即蛋白丢失性胃肠病,其病因较多,包括胃肠道黏膜屏障被破坏、胃肠道血管通透性增加及淋巴管系统压力增高等,均可引起血清蛋白自胃肠道渗漏,从而引发低蛋白血症和水肿等一系列症状。
Step 2 完善辅助检查
Step 3 病情分析
病例1 如何评价肝脏情况?有蛋白丢失的征象及证据吗?
虽然患者存在明确乙型肝炎病毒(HBV)感染,但无乏力、纳差等肝功能减退表现;血清胆红素、前白蛋白及凝血酶原时间正常,Lp-a显著升高,提示肝脏合成蛋白功能及胆红素代谢功能代偿良好;肝脏形态大致正常,无脾大、门脉增宽等门脉高压征象,因此,无肝炎后肝硬化证据,难以用HBV感染解释低蛋白血症。
患者D-木糖实验正常,提示小肠吸收功能正常;便苏丹Ⅲ染色阳性提示可能存在消化不良,补充胰酶后虽苏丹Ⅲ染色转阴,但血清ALB水平仍然逐渐下降。因此,要重点明确有无蛋白丢失因素。
患者低蛋白血症的特点是血清ALB和TP均降低,ALB/球蛋白比例下降不明显,血清蛋白分析结果提示患者血清蛋白普遍减少,而半衰期短者(前白蛋白、凝血因子)正常,符合蛋白丢失所致低蛋白血症特点。
患者多次查尿蛋白正常,24小时尿蛋白定量正常,可除外经肾脏丢失蛋白;患者亦无浆膜腔丢失蛋白证据,因此,应考虑蛋白丢失性胃肠病可能。此外,虽铜蓝蛋白、α1-抗胰蛋白酶等浓度下降,但肝脏及其他方面表现不支持威尔森病或α1-抗胰蛋白酶缺乏症。这些蛋白降低更可能的原因是丢失过多。
病例2 低蛋白血症的原因是什么?有蛋白丢失的征象及证据吗?
患者腹泻水肿数十年,病情反复,可自行消退,主食麦类与大米,其母亦有脚肿及脸肿情况,应首先考虑有无吸收不良。如麦胶性肠病,属原发性肠源性吸收不良,因食物中麦胶蛋白致病,主要累及小肠黏膜层,黏膜次全或完全萎缩,吸收面积减少。临床表现为脂肪泻、消瘦及继发性维生素和矿物质缺乏。诊断主要依靠病理,可行胃镜检查,取小肠黏膜组织,并嘱患者进食无麦胶饮食,观察大便及ALB情况。本患者便苏丹Ⅲ染色及抗麦胶抗体阴性,不支持该诊断。
患者血清ALB及免疫球蛋白同步下降,同样符合蛋白丢失所致的低蛋白血症的特点;24小时尿蛋白定量正常,除外经肾脏丢失蛋白,亦无浆膜腔丢失蛋白证据。因此,应考虑有无蛋白丢失性胃肠病可能。
患者外周血及各亚群淋巴细胞计数明显减少,高度提示应考虑有无小肠淋巴管扩张症可能。该病是小肠黏膜淋巴管结构缺陷或淋巴回流受阻,导致淋巴管扩张,不能正常接受乳糜微粒和淋巴(包括淋巴细胞)回流。此类患者多有腹泻,约半数粪便有乳糜液;外周血淋巴细胞计数显著下降。诊断依赖于病理检查,同样须胃镜取病理活检证实。
Step 4 进一步完善检查
病例1
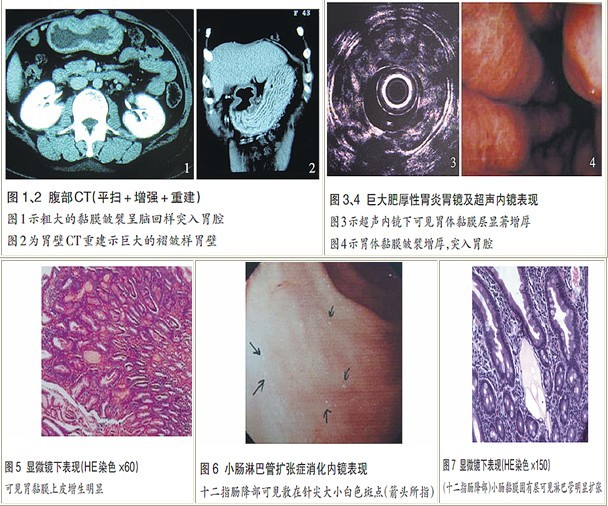
腹部增强CT示胃体部胃壁呈脑回样改变(图1、2);全消化道造影示胃黏膜增宽,未见破坏;超声内镜(EUS)检查示胃体黏膜弥漫性充血水肿,肿胀明显,黏膜皱襞增厚,胃底、胃体黏膜层显著增厚,约0.6~0.8 cm,呈中等回声,内部可见不规则低回声,胃窦黏膜层轻度增厚(图3、4),黏膜下层以下结构大致正常;胃镜下于胃体中部粗大皱襞处行黏膜活检,病理结果示:(胃体)黏膜上皮增生,胃黏膜呈急性及慢性炎,不除外巨大肥厚性胃炎(图5)。
病理科会诊:胃窦及移行部黏膜轻度浅表性胃炎,伴腺颈部上皮炎症性或反应性增生,符合肥厚性胃炎表现。
胃黏膜银染:幽门螺杆菌(Hp)阴性。
病例2
口服小肠造影未见明显异常;腹盆CT示双肾多发盂旁囊肿,右肾下极多发囊肿,盆腔未见明显异常; 胃镜达十二指肠下角接近水平部,见球后及降部黏膜轻度充血肿胀,表面有散在白色斑点(图 6),诊断为十二指肠白色斑点性质待定(小肠黏膜淋巴管扩张?),病理诊断:(十二指肠降部)小肠黏膜呈慢性炎,固有层可见多个淋巴管明显扩张(图7)。
Step 5 最终诊断
病例1 什么是巨大肥厚性胃炎?如何诊断?
巨大肥厚性胃炎又称胃黏膜巨大肥厚症或梅内特里埃(Ménétrier)病,是一种因胃黏膜过度增生引起的胃黏膜皱襞肥厚巨大的良性增生性胃病。临床表现多样,约80%患者有继发于胃肠蛋白丢失的低蛋白血症,常以低蛋白血症表现为首发症状,如双下肢水肿和腹腔、胸腔积液等。影像学表现具特异性,胃肠道钡餐检查可见增大、卷曲的胃壁轮廓;CT表现为巨大黏膜皱襞向胃腔内隆起,胃腔变小,外壁(浆膜层)光整,周围脂肪层清晰。诊断主要依靠内镜及组织病理学检查:① 内镜下可见不规则巨大肥厚胃黏膜,呈脑回样、结节状或融合成息肉状;② 超声内镜下胃壁全层结构完整,仅有黏膜层增厚和回声增强,黏膜下和肌层正常;③ 组织学特征为胃壁黏膜层表面和腺体大量黏液上皮细胞增生、胃小凹高度增生、胃腺体萎缩。
本患者首发及突出表现为双下肢水肿和低蛋白血症,符合巨大肥厚性胃炎主要表现;消化道钡餐检查、CT结果符合典型影像学表现;内镜下及组织病理学结果亦与之相符,考虑诊断为巨大肥厚性胃炎。
病例2 什么是小肠淋巴管扩张症?如何诊断?
小肠淋巴管扩张症是由各种原因导致小肠淋巴管引流受阻,管内压力增高,淋巴管扩张、破裂,淋巴液漏出,多种蛋白及淋巴细胞经肠道丢失。常见继发因素包括肠系膜结核、外伤、腹膜后淋巴瘤及腹膜后纤维化等,主要是因病变压迫、浸润使淋巴回流系统受阻。右心衰、缩窄性心包炎也能导致继发性小肠淋巴管扩张,是因中心静脉压升高使淋巴回流受阻。在除外继发因素后,考虑原发性小肠淋巴管扩张症,即因小肠黏膜淋巴管结构缺陷而致淋巴管扩张,可于成年起病。
该病主要临床表现包括腹泻、外周水肿、低蛋白血症及外周血淋巴细胞减少等;小肠黏膜(包括十二指肠黏膜)有典型的淋巴管扩张表现,即弥漫性白色点状结节、绒毛状隆起及乳糜样物覆盖于小肠黏膜;确诊主要依靠病理,内镜下活检可见小肠黏膜或黏膜下层淋巴管扩张。
本患者多年慢性腹泻、外周浮肿、血蛋白和外周血淋巴细胞计数减少,内镜和病理活检有典型表现,确诊为小肠淋巴管扩张症,因未发现可能的继发因素,考虑为原发性小肠淋巴管扩张症。
Step 6 治疗
病例1
考虑巨大肥厚性胃炎与Hp感染可能相关,虽然患者胃黏膜Hp银染阴性,仍不除外假阴性可能,予三联抗Hp诊断性治疗。患者血清白蛋白(ALB)仍进行性下降,提示抗Hp治疗效果不佳。予泼尼松40 mg/d口服,并加用拉米夫定进行保护性抗病毒治疗。
治疗1个月后,患者血清ALB渐增至35 g/L,水肿消退。泼尼松渐减至10 mg/d,复查血清ALB为 37.5 g/L,胃镜及EUS提示胃体黏膜粗大增厚略减轻。随诊1年(停用泼尼松半年),血清ALB维持正常。
在巨大肥厚性胃炎的治疗中,曾经应用过包括抑酸剂、抗胆碱能药物、糖皮质激素、H2-受体拮抗剂、质子泵抑制剂及前列腺素等多种药物,但无一种药物可完全缓解患者的病情。多宗文献报道成人巨大肥厚性胃炎与Hp感染有一定关系,在根除Hp后,可使部分患者胃黏膜恢复正常,相关临床症状如低ALB血症等获得缓解。对本患者行诊断性抗Hp治疗无效,提示其发病与Hp感染无关。
应用奥曲肽治疗巨大肥厚性胃炎可缓解胃肠道蛋白丢失,可能与其阻断表皮生长因子(EGF)的促细胞增殖作用相关。另有少量个案报道,在应用糖皮质激素治疗巨大肥厚性胃炎后,血清ALB恢复正常。本患者免疫相关指标阴性,无自身免疫性疾病临床表现,用糖皮质激素后血清ALB增长明显,低蛋白血症症状明显改善,胃体黏膜略有恢复,提示治疗有效。
对于存在顽固性疼痛、严重水肿及低蛋白血症、消化道出血、幽门梗阻、不能排除恶性变的患者,提倡手术治疗。
病例2
在患者诊断明确后,予中链甘油三酯(MCT)饮食,并予补充白蛋白及利尿治疗。治疗后,患者血清ALB相对稳定,双下肢水肿明显缓解。
对于原发性小肠淋巴管扩张症,尚无特效治疗方法,采用低脂、高蛋白并补充MCT的饮食调节法是目前最主要也是最基础的治疗方法,其作用机制为,MCT不需要在肠道脂化,可绕过肠道淋巴系统,直接被门静脉系统吸收,从而降低小肠淋巴管内压力,避免了长链脂肪酸吸收后淋巴管内压力升高致淋巴管破裂,减少了蛋白和淋巴细胞漏出。同时,利尿和白蛋白输注等可作为辅助治疗,以缓解低蛋白血症,减轻水肿症状。
此外,奥曲肽能减少肠道血流及淋巴液流量,从而减少蛋白漏出,对疾病缓解有一定帮助。
对于病变局限且部位明确的患者,可通过切除病变部位缓解病情。[6111001]
■ 点评
对于低蛋白血症,要考虑到蛋白丢失性肠病这个少见但重要的原因。胃肠道丢失蛋白一经确诊,须依靠病史、影像学、内镜检查及病理诊断明确病因,进行针对性的治疗。(朱峰)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#胃肠病#
31