中药材进入欧盟市场的关键质量因素
2023-01-23 August MedSci原创 发表于安徽省
中草药在疾病防治方面具有独特的优势,在世界范围内得到广泛认可。越来越多的CHM在国际市场上越来越受欢迎。然而,CHM的质量控制是其在国际市场上接受和认可的一个重要问题。
CHM的质量要求在中药国际化中起着至关重要的作用。特别是一些国家的药典对信息交换所机制的质量控制提出了基本要求,这已成为这些国家信息交换所机制市场准入的门槛。比较不同药典中CHM的质量标准,很明显它们在CHM的种类和数量以及各论中规定的项目方面存在差异。此外,其他国家药典中记录的信息交换所机制的数量和要求与ChP中的记录存在显着差异。这种现状极大地限制了中医药在国际上的接受。
欧洲药品质量管理局(EDQM)和欧洲药品管理局(EMA)在欧盟草药产品监管方面的不同作用:

与西医相比,CHM有其独特之处。需要在中医理论体系的指导下兼容使用。这应考虑到CHM制剂的质量控制。然而,由于许多信息交换所机制缺乏有效物质的证据以及现有技术的局限性,仍然没有一套匹配的标准。在现有的CHMs质量标准中,质量标志通常只是一种或两种成分或一类物质,如挥发油,这往往无法准确评估CHM的质量。因此,如何对CHMs的质量标志进行系统研究并实现技术突破,从而建立一套领先的质量控制技术和国际标准,将成为CHMs质量控制领域的研究热点和挑战。 这一目标的实现将极大地促进中医药的国际化,造福人类健康。值得一提的是,系统生物学和网络药理学侧重于生物系统中的复杂相互作用,研究药物作用和与多个靶点的相互作用,有可能成为系统研究CHMs有效物质的有用和重要工具。最重要的是,循证临床调查目前被认为是科学接受CHM的黄金标准。从这个角度来看,如何将西方医学与中医理论和哲学联系起来仍然被认为是一个挑战。中医的防治策略是多靶点、非线性的。研究不同学科与系统药理学的结合可能会为未来的医学科学提供一些启示。
欧盟和中国之间草药产品制造过程的不同概念:

中药材生产的各个方面都需要对CHM进行质量控制。建立欧盟质量标准和CHM的正式注册将是进入欧盟市场的第一步。首先,CHM的质量应根据欧洲药典原则和EMA指南进行控制。欧盟中草药和提取物的质量主要由欧洲药典定义,而草药产品的功效和安全性指南由EMA制定。在欧盟,将草药产品推向市场有三种主要的监管途径,包括传统用途注册、成熟使用MA和独立的MA完整MA或MA混合申请。它们根据CHM的具体情况适用,例如药用史和给药方法。需要注意的是,不同的注册途径可以应用于不同的程序,这些程序涉及EMA中的国家,相互承认,分散程序和集中程序。事实上,CHM进入欧洲市场一直存在一些障碍。这主要是由于中国制药公司对欧盟CHM质量控制的理解不明确。因此,在此综述中,通过比较欧盟和中国CHM的质量标准,详细阐述了差异。中国企业在将中药材产品引入欧盟市场时,应关注并把握好这些差异,以节省成本并实现更平稳的运营/过渡。此外,中药颗粒作为特例,在该综述中单独阐述。在欧盟,中药颗粒被视为食品补充剂,但在德国,中药颗粒作为医药产品进行管理和监控,这需要引起中国相关企业的关注。
监测草药产品质量的关键步骤:
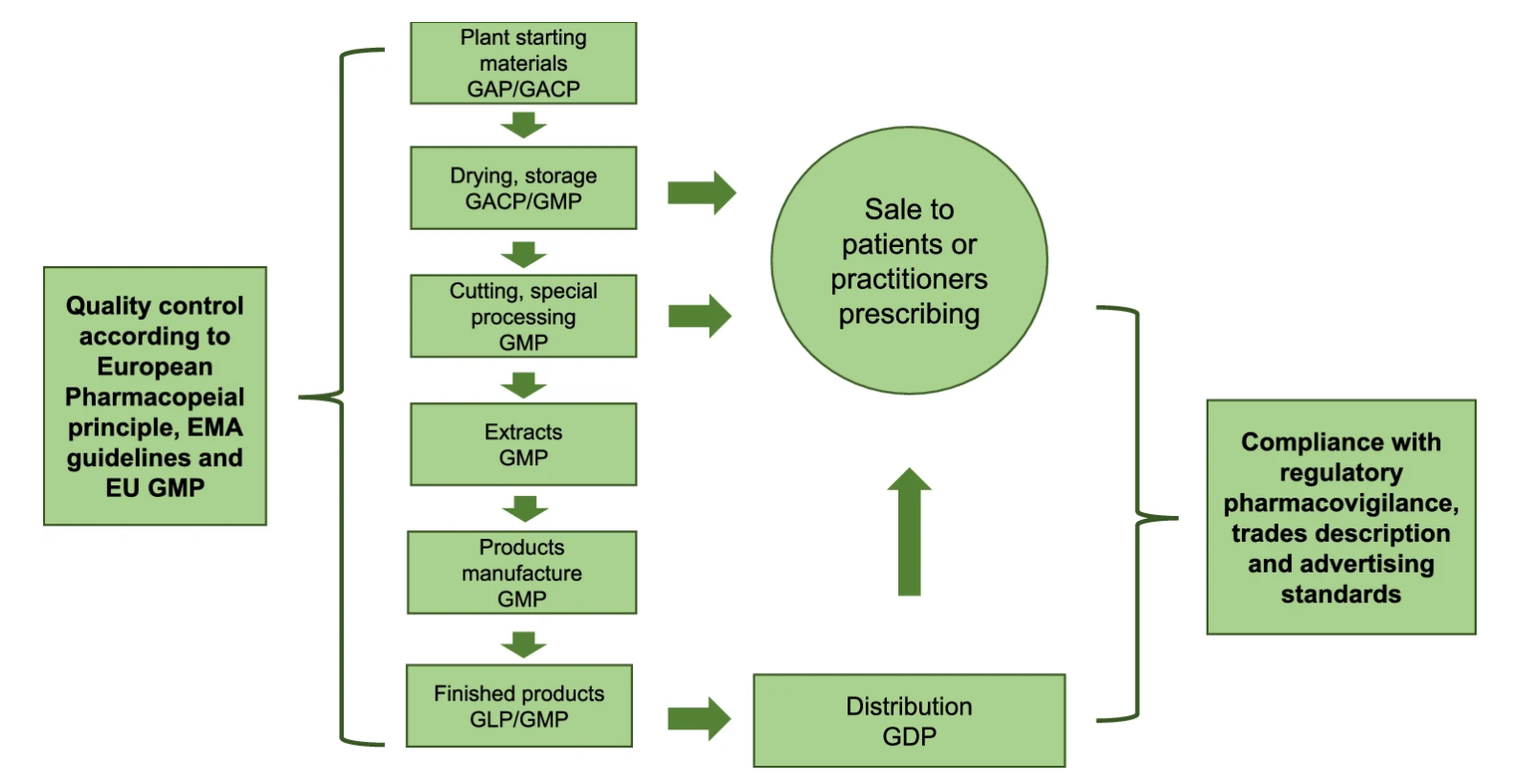
参考文献:Wang M, Yao PF, Sun PY, Liang W, Chen XJ. Key quality factors for Chinese herbal medicines entering the EU market. Chin Med. 2022;17(1):29. Published 2022 Feb 22. doi:10.1186/s13020-022-00583-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







