电阻抗成像技术指导接受静脉-动脉体外膜氧合治疗的患者设定最佳呼气末正压
2023-02-09 网络 网络 发表于上海
本研究旨在评估电阻抗成像技术(electrical impedance tomography,EIT)在VA-ECMO 期间对机械通气患者最佳PEEP设置的指导意义。


四川省人民医院 黄晓波 译
东南大学附属中大医院 张曦文 审
首都医科大学附属北京天坛医院 周建新 述评
四川省人民医院 黄晓波 述评
目的:接受静脉-动脉体外膜氧合(venoarterial extracorporeal membrane oxygenation,VA-ECMO)治疗的患者除了易发生心力衰竭外,还存在许多肺部并发症的危险因素。如何设置这些患者的最佳呼气末正压(positive end-expiratory pressure,PEEP)尚不清楚。
本研究旨在评估电阻抗成像技术(electrical impedance tomography,EIT)在VA-ECMO 期间对机械通气患者最佳PEEP设置的指导意义。
设计:前瞻性单中心观察性研究。
单位:大学附属医院。
患者:18岁以上、接受机械通气和VA-ECMO的患者(n = 23)。
干预措施:以5 cm H2 O为梯度进行PEEP滴定试验(20 cm H2 O -5 cm H2 O),并通过一系 列临床参数、通气和超声(心脏和肺)监测,根据呼吸标准确定最佳PEEP(医生根据呼吸参数选择的最佳PEEP),然后根据血流动力学和心脏耐受性进行调整(医生根据呼吸、血液动力学和超声心动图参数选择最佳PEEP)。与此同时,记录并回顾分析EIT的数据(通气区域分布、顺应性和过度膨胀塌陷),以确定最佳PEEP。
测量与主要结果:纳入的人群中,最佳PEEP的中位数为10 cm H2 O。EIT显示,增加PEEP会促进腹侧肺的过度膨胀,在PEEP为20 cm H2 O时达到最大[34%(四分位距,24.5~40)]。降低PEEP会导致背侧肺塌陷[29%(四分位数距,21~45.8)]。医生根据呼吸参数选择的最佳PEEP与EIT选择的PEEP无差异。然而,高水平的胸腔内压对血流动力学和心脏耐受性有负面影响。
结论:EIT可预测VA-ECMO患者的最佳PEEP,并在超声心动图的辅助下可优化血流动力
学的评估和管理。
关键词:电阻抗成像技术;体外膜氧合;心力衰竭;机械通气;呼气末正压
静脉-动脉体外膜氧合(venoarterial extracorporeal membrane oxygenation,VA-ECMO)是一种心脏循环支持方法,用于维持血流和气体交换,以确保对于常规治疗无效的心源性休克患者的器官灌注和氧合[1-4]。
VA-ECMO患者呼吸衰竭的危险因素有很多:急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、吸入性肺炎、继发于体外心脏按压的肺挫伤和心源性肺水肿[5,6]。大多数VA-ECMO 患者需要机械通气,这可能会产生具有危害的“呼吸机相关性肺损伤”(ventilator-in duced lung injury,VILI)[7]。VA-ECMO治疗期间有关机械通气管理的建议有限,但考虑到VILI的风险和ECMO对气体交换的支持和保证,使得机械通气患者可维持在小潮气量(tidal volume,TV)下进行通气[8-10]
由于心肺的交互作用,高水平呼气末正压(positive end-expiratory pressure,PEEP)水平可能对全身心血管功能产生重大影响[11-14]。CT扫描被认为是评估PEEP试验对肺通气影响的金标准[15],但可能需要将机械通气患者进行院内转运。
电阻抗成像技术(Electrical impedance tomography,EIT)是一种无创、无辐射的工具,可以用于床旁实时监测肺通气分布[16]。EIT原理是基于在胸腔周围的电极上施加低强度的交流电(5 mA,50kHZ~70kHz)。胸部阻抗的变化受肺部空气和血液含量周期性变化的影响,因此EIT可以描述区域通气分布的不平衡[16-19]。
一些研究已经评估了EIT在评估可视的肺泡塌陷和过度膨胀的能力及其在选择最佳PEEP水平方面的价值[20,21]。此外,Franchineau等人[22]已经证明了这种监测对静脉-静脉ECMO 患者选择最佳的PEEP水平有益处。而VA-ECMO依赖患者的最佳PEEP对心肺的影响亟待探究。在这方面,EIT提供了一种潜在的预测性床边无创工具,用于实时监测ECMO患者PEEP的效应以及通气分布。
本研究旨在评估EIT帮助医生在PEEP试验期间为VA-ECMO治疗和机械通气的患者选择最佳PEEP的能力。该研究评估了通过传统呼吸标准(PEEPlung)选择的最佳PEEP与EIT测量值之间的关系。
方法概况
这是一项在有24张病床的综合ICU中开展的为期9个月的观察性前瞻性单中心研究。该项目获得大学附属医院研究伦理委员会批准(n°02-2015)。
患者
纳入研究的患者(n = 23)年龄>18岁、接受机械通气和VA-ECMO,且镇静后的Richmond评分< -3。排除标准主要是使用EIT或应用高水平PEEP的禁忌症:脊柱病变或不稳定性脊
柱骨折,以及使用起搏器或植入式心脏除颤器的患者。未成年患者、受监护的成年人、囚犯和怀孕患者也被排除在外。
方案
患者使用压力控制模式通气,TV设置小于6 mL/kg预测体重。医生设定呼吸频率及初始PEEP,并使得驱动压力小于14 cm H2 O。目标是维持呼吸系统的吸气末平台压,测量方法为在1秒无气流后测量,气道压力不超过30 cm H2 O且动脉血 pH值在7.20~7.45之间。患者可进行镇静并使用神经肌肉阻断剂。如果有必要在方案开始前纠正低血容量,则使用晶体液扩容。纳入研究时需进行超声心动图和六点法肺超声检查。
在患者胸部放置一条带有16个电极的硅胶带,通过超声波控制确认膈上位置。再将它连接到EIT监视器(Pulmovista 500, Dräger, Lübeck, Germany)。
该方案分两个阶段进行:肺复张(保持40 cm H2 O的压力持 续40 s),然后以5 cm H2 O为幅度(从20 cm H2 O到5 cm H2 O) 进行PEEP滴定,同时保持驱动压为10 cm H2O。在每个PEEP水平上,我们监测了:
1)临床血流动力学参数、呼吸和通气参数,
2)肺部超声和经胸超声心动图左、右心室功能参数, 这个过程持续了约一个小时,在每个PEEP水平上分步进行15~20分钟。
由呼吸参数选择的最佳PEEP被称为“PEEPlung”:从通气参数(由呼吸机测量的静态顺应性和TV)、临床参数(Spo2 和Etco2 )和肺部超声参数获得。对每个区域的模式进行定义,以便计算出一个区域的通气分数以描述前肺、侧肺和后肺的特点。根据观察到的最差的超声模式来分配分数。
由医生根据呼吸、血液动力学和超声心动图参数选择的最佳PEEP(PEEPheart+lung)是根据最佳呼吸参数和由临床参数(MAP)和超声心动图参数评估的心脏耐受性(定义最佳左心室和右心室功能)之间的最佳折中选择。PEEPlung和PEEPheart+lung由两位不同的医生根据所有这些参数进行定义,并且总是相似。
同时,在整个方案中记录EIT数据,并随后进行分析。
电阻抗成像数据
EIT数据在整个方案中记录,频率为20 Hz。获得的图像在32×32像素图像上显示彩色编码的阻抗变化。我们根据前后径定义了四个大小相同的感兴趣区域,分别命名为:腹侧、中腹、中背和背侧区域。
每个PEEP水平的阻抗变化[称为“潮汐阻抗变化”(tidal impedance variation,TIV)]定义为吸气末测得的阻抗与呼气末测得的阻抗之间的差异。它与TV相关[17,23]。不同感兴趣区域的阻抗变化以TIV的百分比进行测量。
最后,记录所有数据,以便对EIT根据原始阻抗数据计算出的不同参数所定义的最佳PEEP进行回顾性分析(附录1,http://links.lww.com/CCM/G180)。这项分析是在个人电脑上使用专用软件EITdiag(Drager Medical)进行的。 分析的参数包括:
1)“EIT衍生顺应性(EIT-derived compliance,Z-COM-P)”:Z-COMP根据直接从呼吸机记录的阻抗变化和压力水平计算得出。此参数最高的PEEP水平称为“PEEP Z-COMP”。
2)“过度膨胀和塌陷(Overdistension and collapse, ODCL)”:根据Costa等人的研究[24],TIV的变异性提供了对全肺和局部区域过度膨胀(overdistension,OD)和塌陷(collapse lung,CL)的估计。从这些数据中,使用称为“ODCL”的参数作为ODCL百分比的总和。在我们的研究中,最低ODCL的PEEP水平称为“具有最小ODCL参数的PEEP(PEEPOD CL)”。这些参数的计算详见附录2(http://links.lww.com/C-CM/G180)。
统计分析
描述性统计的第一步,使用Shapiro-Wilk检验评估数值的分布,并分析超量系数(峰度)和偏度。由于许多变量为非高斯分布,因此采用非参数检验进行统计分析。结果以定量变量的中位数和四分位间距(interquartile range,IQR)以及定性变量的数量和百分比表示。
Wilcoxon检验用于比较两个匹配的连续变量。为了比较多次重复测量和四个PEEP水平下记录的不同变量,我们使用了Friedman检验。我们使用了相关表评估不同变量之间的关系,并通过Spearman等级相关系数进行量化。
根据这四个等级定性评估最佳PEEP(PEEPODCL和PEEP Z-COMP)的不同估计值。然后通过计算Cohen kappa 系数来分析与参考PEEP(PEEPlung)的一致程度。对于该系数值的解释,我们使用了Landis和Koch提供的阅读网格(Kappa < 0:对应性差;0~0.20:轻微对应;0.21~0.4:一般对应;0.41~0.6:中等对应;0.61~0.8:基本对应;0.81~1:几乎完美对应)。该研究在MedCalc统计软件(MedCalc Software bvba, Ostend, Belgium)上进行。P小于0.05视为具有统计学意义。
结果
研究人群
在9个月的研究期间,我们对33例患者进行了筛查,23例患者被纳入本项研究(参见附录3中的流程图,http://links.lw-w.com/CCM/G180)。患者纳入时间均较早,ECMO实施的中位数(IQR)为16小时(11~23小时)。样本特征见附录4 (http://links.lww.com/CCM/G180)。大多数患者为男性(65.2%),中位年龄为55岁(IQR,43.5~64岁),简化急性生理学评分II严重程度评分为61(IQR,48~72)。所有患者均经外周血管插管(股静脉股动脉)。
PEEP对血流动力学、呼吸、机械通气特性和电阻抗参数的影响
呼吸和血流动力学参数
按PEEP水平划分的通气和血流动力学参数见附录5(http://links.lww.com/CCM/G180)。结 果表明,在PEEP 10和PEEP 15时,TV明显较高,在肺静态顺应性方面也观察到这种趋势。驱动压维持在10 cm H2 O时导致 较低的TVs(在PEEP为10时,最大5.2mL/kg理想体重)。研究期间血流动力学变化没有显著差异:在每个PEEP水平上,MAP、舒张压和心率都没有差异。
超声心动图参数
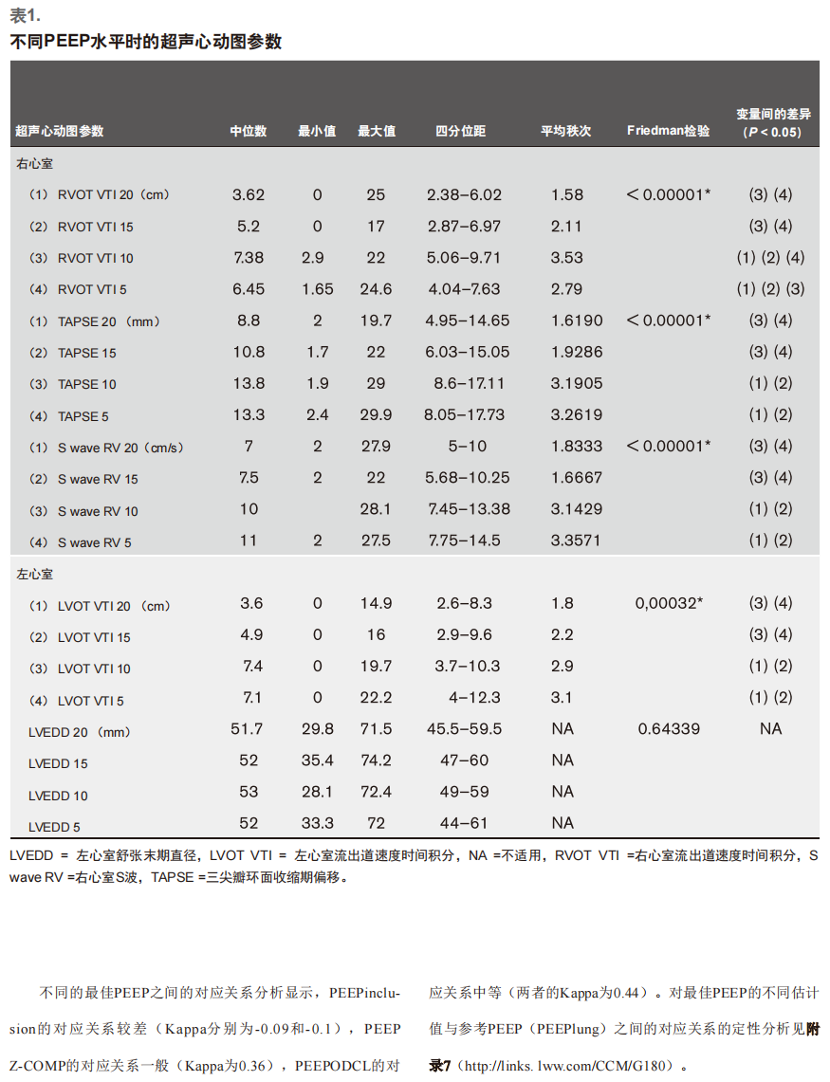
超声心动图数据分析确定了两个统计学上不同的组别:“高水平PEEP”组-PEEP 20和15 cm H2 O及“低水平PEEP”组-PEEP 10和5 cm H2 O。对于肺动脉瓣处速度-时间积分(VTI)、三尖瓣环平面收缩偏移、右心室S波和主动脉瓣处VTI,Friedman检验显示高PEEP水平和低PEEP水平之间存在显著差异,低PEEP水平组的数值更高。在该组中,PEEP 5时肺动脉瓣处VTI[6.45(4.04~7.63)]显著低于PEEP 10时的VTI[7.38(5.06~9.71)](表1)
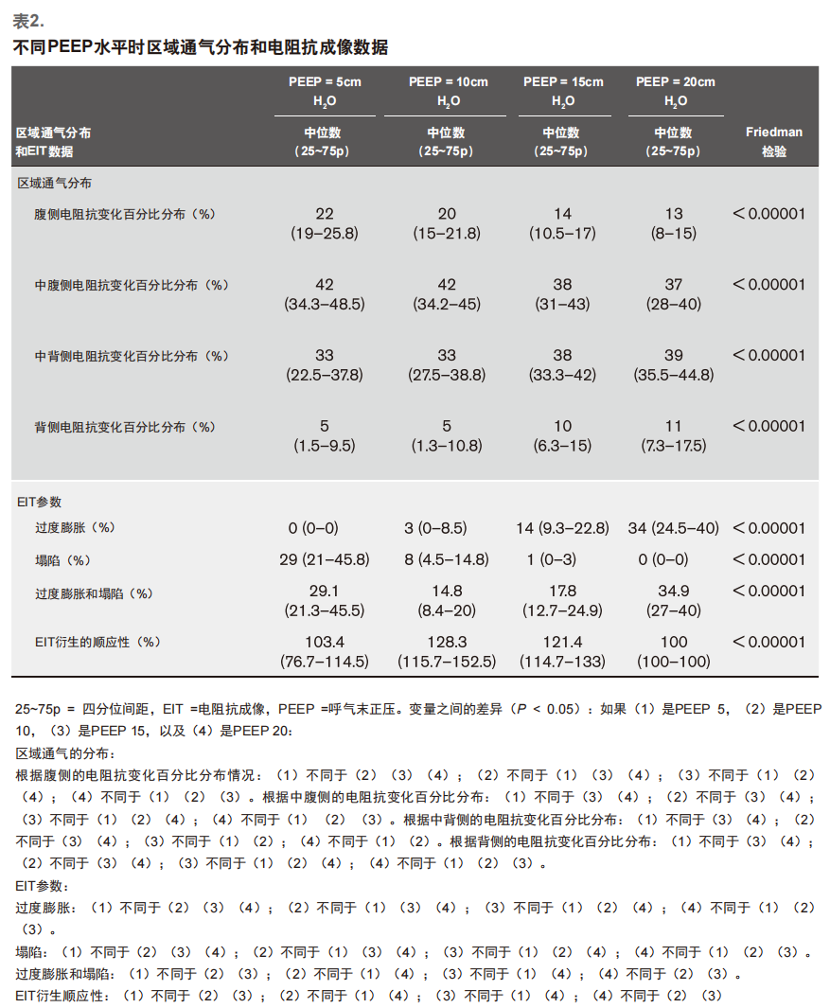
电阻抗参数表2
显示了不同PEEP水平时的区域通气分布和EIT数据。“z-顺应性”的参考水平是PEEP 20或100%;该值在所有PEEP水平时均较高,最高为PEEP 10(128.3%;P < 0.00001)。ODCL在PEEP 10时也是最小的,在PEEP上限和下限时的数值较高(表2)。
如图1所示,从PEEP 20到PEEP 5,OD和CL参数随着OD的减少和CL的增加而发生相反变化(P < 0.00001)。
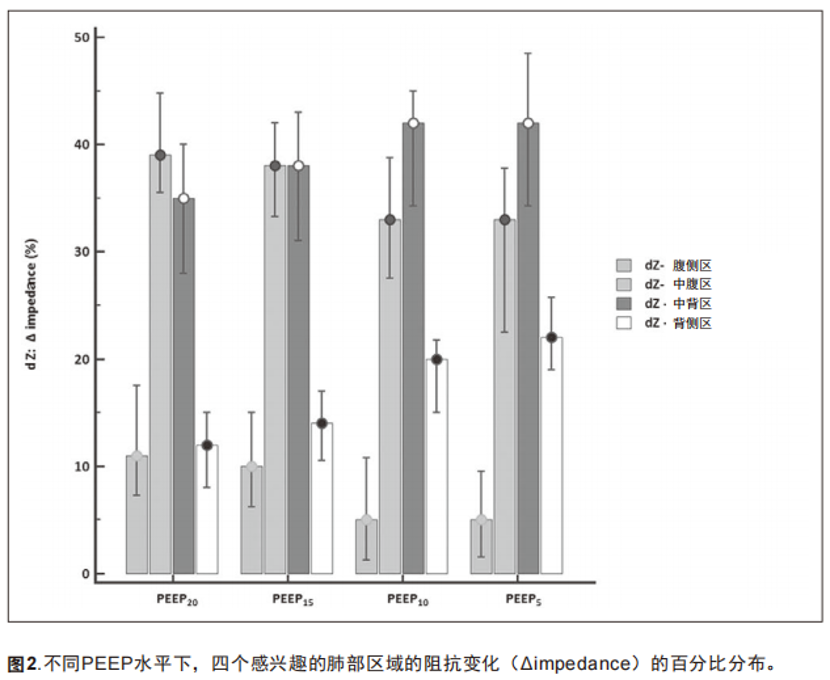
PEEP的降低也改变了通气的区域分布。腹侧感兴趣区 (ventral area of interest,dZ-V)阻抗变化的百分比从PEEP 20 [(12% [8%~15%)]到PEEP 5 [22%(19%~25.8%)]变化越来越大。在背侧区域,dZ-D阻抗变化百分比从PEEP 20时的11%降至PEEP 5时的5%。图2显示了四个感兴趣区域中每个区域的区域通气变化。
我们测量了各种通气参数和EIT衍生参数之间的相关性(附录6,http://links.lww.com/CCM/G180)。为患者选择的PEEP与参数OD(rho = 0.884)和CL(rho = -0.901)之间存在高度的相关性。如表所示,其他的相关性也有统计学意义, 但相关程度较低,如z顺应性和呼吸顺应性,Z-COMP和TV ODCL和TV,以及ODCL和呼吸顺应性。在四个感兴趣的区域[dZ-V、根据中腹侧的电阻抗变化百分比分布(dZ-MV)、根据中背侧的电阻抗变化百分比分布、以及dZ-D]与参数OD和CL之间也发现有相关性。
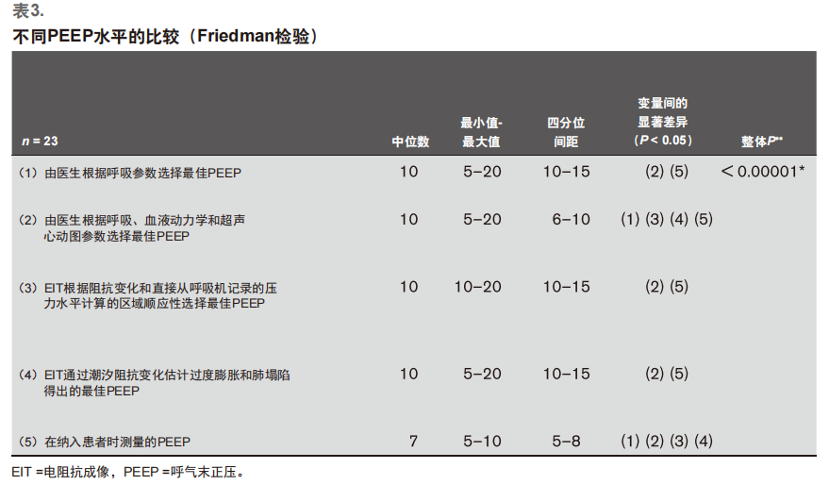
不同最佳PEEP间的比较
比较不同PEEP的统计分析表明,所检测的 PEEP, 即 PEEPlung, 与PEEPODCL和PEEP Z-COMP之间没有明显的差异。另一方面,基于电阻抗参数定义的最佳 PEEP之间也没有显著差异: PEEPZ-COMP和PEEPODCL。纳入患者时测得的PEEP(PEEPincl)与评估的所有最佳PEEP测量值都有显著差异(表3)。
不同的最佳PEEP之间的对应关系分析显示,PEEPinclu-sion的对应关系较差(Kappa分别为-0.09和-0.1),PEEP
Z-COMP的对应关系一般(Kappa为0.36),PEEPODCL的对应关系中等(两者的Kappa为0.44)。对最佳PEEP的不同估计值与参考PEEP(PEEPlung)之间的对应关系的定性分析见附录7(http://links. lww.com/CCM/G180)。

讨论
据我们所知,这是第一项评估EIT在VA-ECMO患者中选择最佳PEEP的价值的研究,提供了关于区域通气、肺泡塌陷和肺部过度膨胀的信息。
从EIT监测胸腔横断面的阻抗数据可以得到全肺和区域肺部通气和换气的信息,因为区域空气含量的变化与胸腔阻抗的变化有关[25]。一些研究对基于EIT的测量进行了验证。 Victorino在10例机械通气的成人患者的研究中发现EIT成像和动态CT扫描之间的良好一致性,因为EIT提供的定量信息与空气含量的变化有着良好的比例关系[23]。Mauri等人[26]还将EIT测量的肺部体积变化与氦气稀释值进行了比较,并取得了良好的一致性。
Costa等人[24]提出使用EIT量化塌陷和过度膨胀,使用基于EIT的算法估算可复张的肺泡塌陷和过度扩张,并与递减PEEP滴定期间的动态CT扫描 (附录1,http://links.lww.com/C-CM/G180)进行比较 [24]。 此外,在动物实验当中,EIT通过通气过程中获得的肺区域阻抗的变化值,可实现对肺区域潮汐性开放与过度膨胀的监测[27]。
Pereira 等人[28]指出,在接受择期腹部手术的患者中,EIT导向的PEEP可减少术后肺不张,同时改善术中氧合和驱动压。此外,Wolf 等人[29]表明,EIT导向的机械通气可改善呼吸力学,改善气体交换,并减少动物模型中VILI的组织学证 据。Franchineau等人[22]阐明了在静脉-静脉ECMO治疗的ARDS患者中使用EIT选择最佳PEEP的益处,以及在超肺保护性通气的情况下使用EIT的益处。
同样,我们的发现说明了在滴定PEEP试验中,区域肺通气的不平衡,背侧区域的通气量减少与肺泡塌陷有关,而腹侧区域的通气量增加则与肺部过度膨胀有关。这些结果与之前描述的结果一致,即在15例ARDS患者的PEEP滴定中发现相同的区域通气变化[22]。这一结果证实了背侧区域通气显著依赖于PEEP水平,腹侧区域是非依赖性通气区域。
一些研究表明,在ARDS患者的保护性机械通气过程中,这种非依赖性和依赖性的潮气招募同时存在[30-32]。Terragni等人[33]证明,在20例ARDS患者中,尽管有保护性通气,但在CT上观察到的潮气过度膨胀可导致肺部炎症加重和通气时间延长。
Z-COMP参数在整个PEEP试验过程中不断增加,在PEEP10时达到最大值。这一趋势证实了在PEEP 20时存在明显的过度拉伸,而在PEEP 5时,Z-COMP因减员而损失。在我们的研究中,我们发现我们选择的PEEPlung和PEEP Z-COMP之间存在良好的匹配。
ODCL参数来自Z-COMP概念[24]:在PEEP滴定试验中每个像素的Z-COMP变化可用于估计该Z-COMP增加区域的肺泡塌陷,以及估计该Z-COMP减少区域的过度扩张,因为这些算法与胸部CT的相关性很好[19,24]。在我们的工作中,PEEPOD-CL与PEEPlung有适度的对应关系。Su等人[34]将这个EIT参数与18例急性呼吸衰竭患者的呼吸系统顺应性所定义的最佳PEEP进行了比较,具有良好的对应性。
在我们的工作中,我们定义了最佳的PEEP,即在复苏动作之前进行递减的PEEP试验,以获得最大的复苏量[35]。试验前进行了容量扩张。没有观察到重大的血流动力学损害,3例患者出现了脉压下降,但主动脉压(main arterial pressure, MAP)保持不变(附录4,http:// links.lww.com/CCM/G180)。
另一方面,由于超声心动图参数的改变(表1),34.7%的患者 (n = 8)的PEEPheart+lung低于PEEPlung。该结果证实了高水平胸内压对VA-ECMO患者心脏耐受性的负面影响[13,36,37]。 Schmitt等人[38]在16例接受机械通气的ARDS患者中使用心脏超声显示,在最高PEEP水平下右心室射血分(right ventricu-lar ejection fraction,RVEF)降低。在我们的工作中,高水平PEEP组(10 cm H2 O ~15cm H2 O)呈现RVEF下降的改变。 有多种机制:右心房和胸腔内腔静脉受压,使RV的前负荷受损,压力梯度下降,有利于静脉回流[39]。
肺泡外血管的塌陷导致肺血管阻力和RV后负荷增加[13,40]。在最低水平的PEEP下,RVEF又开始降低,这可以用肺不张的出现来解释,导致肺泡内血管塌陷和缺氧性血管收缩[41,42]。高水平的胸内压对左心室(left ventricle,LV)射血分数也有不利影响。高PEEP水平对左心室的潜在好处是降低跨膜压力和左心室后负荷[36,43], 但由于VA-ECMO的动脉化血液持续逆行注入降主动脉,可能会减弱这种获益。由于ECMO是一种临时性的心脏支持疗法,因此在等待心肌功能可能恢复的同时,必须保护心脏功能。
通过与VILI的类比,Luecke和Pelosi[44]描述了高PEEP水平下“呼吸机相关的心脏损伤”的概念。
我们的研究存在一些局限性。
首先,我们的研究人群存在异质性,例如,LV或右心室(right ventricle,RV)功能衰竭之间存在差异。
其次,我们是以5cm H2 O为幅度递减进行PEEP滴定试验。结合我们的结果,通过对PEEPs在5cm H2 O~15 cm H2 O之间应用2 cm H2 O或3 cm H2 O为梯度以更精确地评估区域肺通气的变化,可能会更有意义。
第三,呼吸机测量的静态呼吸顺应性是单周期测量。两个PEEP水平之间的微小变化的临床意义以及我们在这个整体参数上选择PEEPlung的有效性可能会受到质疑,并且可以解释6例患者的PEEPODCL和PEEPlung之间的差异。
第四,本研究的小样本量限制了统计效能,有可能出现第二类错误。
结论
EIT作为一种监测工具,为接受有创机械通气和VA-EC-MO的患者确定最佳PEEP提供了潜在的临床应用价值。在管理VA-ECMO患者时,滴定最佳PEEP有可能改善临床结局。
为了实现这一目标,EIT和超声心动图的结合,也是评估VA-ECMO治疗患者心功能的一个有用的床边工具,也是一种监测心肺功能和提供支持治疗的新方法。
All authors: Intensive Care Unit, Anesthesiology and Intensive Care Department, Toulouse University Hospital, Toulouse, France.
Supplemental digital content is available for this article. Direct URL citations appear in the printed text and are provided in the HTML and PDF versions of this article on the journal's website (http://journals.lww.com/ccmjournal).
Supported, in part, by the institutional and department sources.
The Pulmovista electrical impedance tomography was provided by Dräger(Lübeck, Germany) during the study period. Drager had no role in the study design, collection, analysis, and interpre-tation of the data, writing the article, or the decision to submit the article for publication. The authors have disclosed that they do not have any potential conflicts of interest.
For information regarding this article, E-mail: minville.v@chu-toulouse.fr
参考文献
1. Rao P, Khalpey Z, Smith R, et al: Venoarterial extracorporeal membrane oxygenation for cardiogenic shock and cardiac arrest. Circ Heart Fail 2018;11:e004905
2. Pineton de Chambrun M, Brechot N, Combes A: Venoarterial extracorporeal membrane oxygenation in cardiogenic shock:Indications, mode of operation, and current evidence. Curr Opin Crit Care 2019;25:397-402
3. Tramm R, llic D, Davies AR, et al: Extracorporeal membrane oxygenation for critically ill adults. Cochrane Database Syst Rev 20151:CD010381
4. Guglin M,Zucker MJ, Bazan VM, et al: Venoarterial ECMO for adults: JACC scientific expert panel. J Am Coll Cardio/2019;73:698-716
5. Russo JU, Aleksova N, Pitcher I, et al: Left ventricular unload-ing during extracorporeal membrane oxygenation in patients with cardiogenic shock. J Am Coll Cardio/2019;73:654-662
6. Meani P, Gelsomino S, Natour E, et al: Modalities and effects of left ventricle unloading on extracorporeal life support: A review of the current literature. Eur J Heart Fail 2017; 19(Suppl 2):84-91
7. Parker JC, Hernandez LA, Peevy KJ: Mechanisms of ventila-tor-induced lung injury. Crit Care Med 1993; 21:131-143
8. Serpa Neto A,Cardoso SO,Manetta JA,et al:Association between use of lung-protective ventilation with lower tidal volumes and clin-ical outcomes among patients without acute respiratory distress syndrome:A meta-analysis.JAMA 2012;308:1651-1659
9. Schmidt M, Stewart C, Bailey M, et al: Mechanical ventilation management during extracorporeal membrane oxygenation for acute respiratory distress syndrome: A retrospective inter-national multicenter study. Crit Care Med 2015;43:654-664
10. Marhong JD, Munshi L, Detsky M, et al: Mechanical ventilation during extracorporeal life support(ECLS):A systematic review, Intensive Care Med 2015;41:994-1003
11. Vieillard-Baron A: Heart-lung interactions in the ICU:Physiology, evaluation and clinical applications. Ann Trans/Med 2018;6:346
12. Biondi JW, Schulman DS, Matthay RA: Effects of mechanical ventilation on right and left ventricular function. Clin Chest Med 19889:55-71
13. Biondi JW, Schulman DS, Soufer R, et al: The effect of incre-mental positive end-expiratory pressure on right ventricular hemo-dynamics and ejection fraction. Anesth Analg 1988; 67:14-151
14. Steingrub JS, Tidswell M, Higgins TL: Hemodynamic con-sequences of heart-lung interactions. J Intensive Care Med 2003;18:92-99
15. Nieman GF, Satalin J, Andrews P, et al: Personalizing mechan-ical ventilation according to physiologic parameters to stabi-lize alveoli and minimize ventilator induced lung injury (VIL). Intensive Care Med Exp 2017;5:8
16. Bachmann MC, Morais C, Bugedo G, et al: Electrical imped-ance tomography in acute respiratory distress syndrome. Crit Care 2018;22:263
17. Frerichs I, Hinz J, Herrmann P, et al: Detection of local lung air content by electrical impedance tomography compared with electron beam CT. JAppl Physiol(1985)2002; 93:660-666
18. Frerichs I, Amato MB, van Kaam AH, et al; TREND s: Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: Consensus statement of the TRanslational EIT developmeNt stuDy group. Thorax 2017;72:83-93
19. Costa EL, Lima RG, Amato MB: Electrical impedance tomog-raphy. Curr Opin Crit Care 2009; 15:18-24
20. Gattinoni L, Caironi P, Cressoni M, et al: Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med2006;354:1775-1786
21. Vieira SR, Puybasset L, Richecoeur J, et al: A lung computed tomographic assessment of positive end-expiratory pressure-induced lung overdistension. Am J Respir Crit Care Med 1998;158:1571-1577
22. Franchineau G, Brechot N, Lebreton G, et al: Bedside contri-bution of electrical impedance tomography to setting positive end-expiratory pressure for extracorporeal membrane oxygen-ation-treated patients with severe acute respiratory distress syndrome. Am J Respir Crit Care Med 2017;196:447-457
23. Victorino JA, Borges JB, Okamoto VN, et al: Imbalances in regional lung ventilation: A validation study on electrical im-pedance tomography. Am J Respir Crit Care Med 2004;169:791-800
24. Costa EL, Borges JB, Melo A, et al: Bedside estimation of re-cruitable alveolar collapse and hyperdistension by electrical im-pedance tomography. Intensive Care Med 2009; 35:132-1137
25. Kobylianskii J, Murray A, Brace D, et al: Electrical impedancetomography in adult patients undergoing mechanical ventila-tion: A systematic review. JCrit Care 2016; 35:33-50
26. Mauri T, Eronia N, Turrini C, et al: Bedside assessment of the effects of positive end-expiratory pressure on lung in-flation and recruitment by the helium dilution technique and electrical impedance tomography. Intensive Care Med 2016;42:1576-1587
27. Beda A, Carvalho AR, Carvalho NC, et al: Mapping regional differences of local pressure-volume curves with electrical im-pedance tomography. Crit Care Med 2017;45:679-686
28. Pereira SM, Tucci MR, Morais CCA, et al: Individual positive end-expiratory pressure settings optimize intraoperative me-chanical ventilation and reduce postoperative atelectasis. Anesthesiology2018;129:1070-1081
29. Wolf GK, Gomez-Laberge C, Rettig JS, et al: Mechanical ven-tilation guided by electrical impedance tomography in experi-mental acute lung injury. Crit Care Med 2013; 41:1296-1304
30. Tsuchida S,Engelberts D,Peltekova V,et al:Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med 2006;174:279-289
31. Grasso S, Stripoli T, Sacchi M, et al: Inhomogeneity of lung paren-chyma during the open lung strategy: A computed tomography scan study. Am J Respir Crit Care Med 2009;180:415-423
32. Rouby JJ, Lu Q, Goldstein I: Selecting the right level of pos-itive end-expiratory pressure in patients with acute respi-ratory distress syndrome. Am J Respir Crit Care Med 2002;165:1182-1186
33. Terragni PP, Rosboch G, Tealdi A, et al: Tidal hyperinflation dur-ing low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med 2007; 175:160-166
34. Su PL, Lin WC, Ko YF, et al: Positive end-expiratory pressure selection based on best respiratory system compliance or collapse/hyperdistension curves in patients with acute res-piratory distress syndrome: Lack of correlation with alveolar recruitment. Intensive Care Med 2018; 44:389-391
35. Kacmarek RM,Villar J,Sulemanji D,et al;Open Lung Approach Network: Open lung approach for the acute respiratory distress syndrome: A pilot, randomized controlled trial. Crit Care Med 201644:32-42
36. Jardin F, Delorme G, Hardy A, et al: Reevaluation of he-modynamic consequences of positive pressure ventilation:Emphasis on cyclic right ventricular afterloading by mechan-ical lung inflation. Anesthesiology 1990;72:966-970
37. Lovas A, Szakmany T: Haemodynamic effects of lung recruit-ment manoeuvres. Biomed Res Int 2015; 2015:478970
38. Schmitt JM, Vieillard-Baron A, Augarde R, et al: Positive end-expiratory pressure titration in acute respiratory distress syndrome patients: Impact on right ventric-ular outflow impedance evaluated by pulmonary artery Doppler flow velocity measurements. Crit Care Med 2001;29:1154-1158
39. Pinsky MR: Heart-lung interactions. Curr Opin Crit Care 2007;13:528-531
40. Katira BH, Giesinger RE, Engelberts D, et al: Adverse heart-lung interactions in ventilator-induced lung injury. Am J Respir Crit Care Med 2017;196:1411-1421
41. Moudgil R, Michelakis ED, Archer SL: Hypoxic pulmonary vas-oconstriction. JApp/Physiol(1985)2005; 98:390-403
42. Zochios V, Parhar K, Tunnicliffe W, et al: The right ventricle inARDS.Chest2017;152:181-193
43. Wiesen J, Ornstein M, Tonelli AR, et al: State of the evidence:Mechanical ventilation with PEEP in patients with cardiogenic shock.Heart2013:99:1812-1817
44. Luecke T, Pelosi P: Clinical review: Positive end-expiratory pressure and cardiac output. Crit Care 2005; 9:607-621
专家述评
黄晓波 四川省人民医院
这是一篇评估VA-ECMO期间,使用经典的PEEP滴定法常规驱动压水平设置、根据呼吸参数设置、根据呼吸参数和心脏超声设置、EIT设置最佳PEEP水平的干预性研究,作者用详实的数据,在23例患者身上做了比较,常规驱动压设置PEEP可能会加重肺不均一通气的损害,通过静态顺应性测定或者心脏超声测定循环功能或者EIT测定膨胀塌陷分数设置的PEEP更符合生理。特别我们能看得到,高PEEP带来的损害,提醒临床医生在VA-ECMO期间,要关注呼吸机相关性损伤和呼吸机相关的心脏功能的损害。EIT作为一种无创、无辐射、连续监测的工具,对设置最佳PEEP有一定的指导意义。
周建新 首都医科大学附属北京天坛医院
机械通气是重症医学科(intensive care unit,ICU)重要治疗手段。越来越多的证据表明,机械通气在提供通气和氧合支持的同时,还可能造成呼吸机相关肺损伤(ventilator induced lung injury,VILI)。因此,也形成了肺保护性通气,主要包括三项策略,小潮气量通气以防止肺泡过度膨胀、合适的呼气末正压(positive end expiratory pressure,PEEP)以防止肺泡周期性开放闭合、以及俯卧位通气和肺复张操作以促进萎陷肺泡的重新开放[1]。其中小潮气量通气和俯卧位通气都获得了循证医学证据支持[2,3]。然而,如何选择合适的PEEP水平,是目前的主要难点和研究重点[4]。
PEEP对于机械通气患者是一把双刃剑,设定不足时萎陷区域无法复张,而过高时则导致过度膨胀。因此,萎陷和过度膨胀的评估是临床处理的关键,这就涉及到肺容积测量监测。CT扫描是评价肺内气体分布和复张性的金标准[5]。然而,放射线暴露、患者转运以及计算过程复杂是CT床旁应用的主要限制。气体稀疏法也是实验室测量肺容积的常用方法,目前也开发出呼吸机整合的呼气末肺容积监测手段,但是该方法无法获得区域性肺容积监测。电阻抗成像(electrical impedance tomography,EIT)是近年来逐渐受到临床研究关注的一种肺容积监测手段,优点包括无创、连续、无放射暴露以及能够提供区域性气体分布的数据。该监测手段的技术层面已经相对成熟,也有相应的操作规范发布[6]。
2009年,Costa等建立了整合肺萎陷和过度膨胀的计算方法,在PEEP滴定的过程中,理论上可以得到折中萎陷和过度膨胀的PEEP水平[7]。本期Critical Care Medicine发表了由Soulé等完成的一项前瞻性单中心观察性研究[8]。研究纳入了23例接受静脉-动脉体外膜肺氧合和机械通气的成年患者,应用基本呼吸循环监测、肺超声、心脏超声和EIT监测对呼吸循环功能进行了评估。采用逐步降低法进行PEEP滴定(20-15-10-5 cmH2 O)。比较了三种方法指导理想PEEP水平的设定,
1)肺指标:包括静态顺应性、潮气量、脉搏氧饱和度、潮气末二氧化碳和肺超声;
2)心脏和肺指标:包括上述肺指标加平均动脉压和超声心动图;
3)EIT指标:包括EIT测量的肺顺应性和Costa推荐的肺萎陷和过度膨胀折中法。
三种方法获得的理想PEEP中位数均为10 cmH2 O,然而非参数检验发现,心脏和肺指标指导的PEEP值与其他两种方法存在显著性差异。EIT监测显示,降低PEEP时肺重力依赖区萎陷区域增加,而升高PEEP时非重力依赖区过度膨胀区域增加。该研究结果支持应用EIT预测理想PEEP水平,配合超声心动图监测有助于循环功能评估和处理。
近期发表了两项随机对照试验,探索了应用Costa方法指导PEEP设定对急性呼吸窘迫综合征患者临床转归的影响。其中一项研究的对照组采用了低氧合表法,主要终点指标为28天病死率,结果无统计学差异(21% vs. 27%,P = 0.63) [9]。另一项的对照组则采用了最佳顺应性法,次要终点指标中包括了出院存活率,EIT组明显高于对照组(44.4% vs. 69%,P = 0.02)[10]。这些研究的发表,显示了临床对EIT辅助PEEP设定的关注度。
不同类型的机械通气患者对PEEP的反应性不同,而PEEP的临床效果取决于肺的可复张性[4,5]。到目前为止,尚未证实任何一种方法指导的PEEP设定水平能够改善患者的临床转归[4]。可能的原因则在于这些研究中并未对患者的可复张性进行评估。Soulé等的 研究也存在这样的局限性。EIT除了可以对肺容积进行连续监测外,还可对区域性肺复张进行评价。这也许是未来EIT指导PEEP设定研究中需注意的问题。
参考文献
1.Goligher EC, Dres M, Patel BK, et al. Lung- and Diaphragm-Protective Ventilation. Am J Respir Crit Care Med 2020; 202: 950-961.
2.The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared with traditional tidal volumes for
acute lung injury and the acute respiratory distress syndrome. N Engl J Med 2000; 342: 1301-1308.
3.Guerin C, Reignier J, Richard JC, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013; 368: 2159-2168.
4.Sahetya SK, Goligher EC, Brower RG. Fifty Years of Research in ARDS. Setting Positive End-Expiratory Pressure in Acute Respiratory
Distress Syndrome. Am J Respir Crit Care Med. 2017; 195: 1429-1438.
5.Chen L, Brochard L. Lung volume assessment in acute respiratory distress syndrome. Curr Opin Crit Care 2015; 21: 259-264.
6.Frerichs I, Amato MB, van Kaam AH, et al. Chest electrical impedance tomography examination, data analysis, terminology, clinical use and
recommendations: Consensus statement of the TRanslational EIT developmeNt stuDy group. Thorax 2017; 72: 83-93.
7.Costa EL, Borges JB, Melo A, et al. Bedside estimation of recruitable alveolar collapse and hyperdistension by elec- trical impedance tomog
raphy. Intensive Care Med 2009; 35: 1132-1137.
8.Soulé C, Crognier L, Puel F, et al. Assessment of Electrical Impedance Tomography to Set Optimal Positive End-Expiratory Pressure for
Venoarterial Extracorporeal Membrane Oxygenation- Treated Patients. Crit Care Med 2021; 49: 923-933.
9.He H, Chi Y, Yang Y, et al. Early individualized positive end-expiratory pressure guided by electrical impedance tomography in acute respira
tory distress syndrome: a randomized controlled clinical trial. Crit Care 2021; 25: 230.
10.Hsu HJ, Chang HT, Zhao Z, et al. Positive end-expiratory pressure titration with electrical impedance tomography and pressure-volume
curve: a randomized trial in moderate to severe ARDS. Physiol Meas 2021; 42: 014002.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言