作者:曼话 ,来源:医药魔方Pro
溶瘤病毒(oncolytic viruses)是一类能够优先感染和杀死癌细胞的病毒,有潜力改善对免疫疗法或化疗药物没有反应或耐药的患者的临床结果。然而,尽管这类抗癌疗法已被研究数十年,迄今为止仅有一款基于单纯疱疹病毒1型的溶瘤病毒(T-VEC)获美国FDA批准上市。瘤内注射的T-VEC在治疗黑素色瘤局部病变的患者中显示了疗效,但转移性黑色素瘤很大程度上对T-VEC耐药。
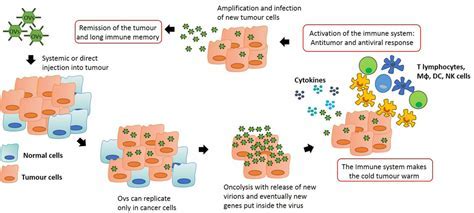
在对抗转移性癌症方面,溶瘤病毒一直面临着一个巨大的障碍,即人类的免疫系统。当溶瘤病毒经系统给药到达血液中后,免疫系统会快速捕获它们。血液中的天然免疫球蛋白M (IgM)抗体和补体成分会通过调节、灭活和靶向血源性病毒,使其被先天免疫系统的吞噬细胞降解。

11月25日,最新发表在Science Translational Medicine杂志上的一项研究中,来自美国埃默里大学和凯斯西储大学的一个研究团队称已经找到了克服这一障碍的方法[1]。他们通过多重改造,成功使人类腺病毒(human adenovirus, HAdv)不会轻易就被先天免疫系统捕获,从而使通过系统递送溶瘤病毒来治疗转移性癌症成为可能。
人类腺病毒(HAdv) 在感染和杀死各种类型的癌细胞方面非常有效。尽管这些特性使HAdv在用于开发溶瘤病毒候选疗法方面极具吸引力,但系统递送HAdv可引发强烈的全身炎症反应和肝毒性,因此限制了该病毒平台的临床应用。研究表明,静脉注射HAdv-C5血清型后,病毒颗粒会迅速被血液中的凝血因子X (coagulation factor X)调理。虽然凝血因子X与HAdv-C5结合可保护病毒免受补体介导的失活,但两者的结合促进了有效的肝细胞感染,引发了肝毒性。此外,凝血因子X与HAdv-C5的结合也增强了先天免疫细胞对病毒的识别,从而促进了全身炎症的激活。在静脉输注后,HAdv颗粒会迅速被吞噬细胞从血液中清除,尤其是肝脏中的Kupffer细胞(位于肝脏中的特殊巨噬细胞)。当被吞噬细胞捕获时,HAdv通过病毒五邻体基质蛋白(penton base protein)中的Arg-Gly-Asp (RGD)氨基酸基序与细胞中的β3整合素(β3-containing integrins)相互作用。在高剂量静脉注射后,这种相互作用会触发促炎IL-1α依赖性信号传导的激活,引发急性细胞因子风暴。因此,开发一种安全有效的适合于系统给药的溶瘤病毒需要多管齐下的方法来调节病毒与体液因子和组织吞噬细胞的相互作用。
埃默里大学的Dmitry Shayakhmetov博士与凯斯西储大学的结构生物学家Phoebe Stewart博士已经合作了15年,他们的研究重点就是“改造腺病毒”。2012年,他们的团队曾在Science杂志上发表了一篇论文,揭示腺病毒是如何与凝血因子X相互作用的[2]。
在这项新研究中,科学家们报道了一种经过多重改造后依然能够装配,且保留着感染和杀伤肿瘤细胞功能的新型腺病毒——Ad5-3M。研究表明,在小鼠模型中,改造后的腺病毒能够有效抑制肿瘤生长,且未表现出毒性作用。
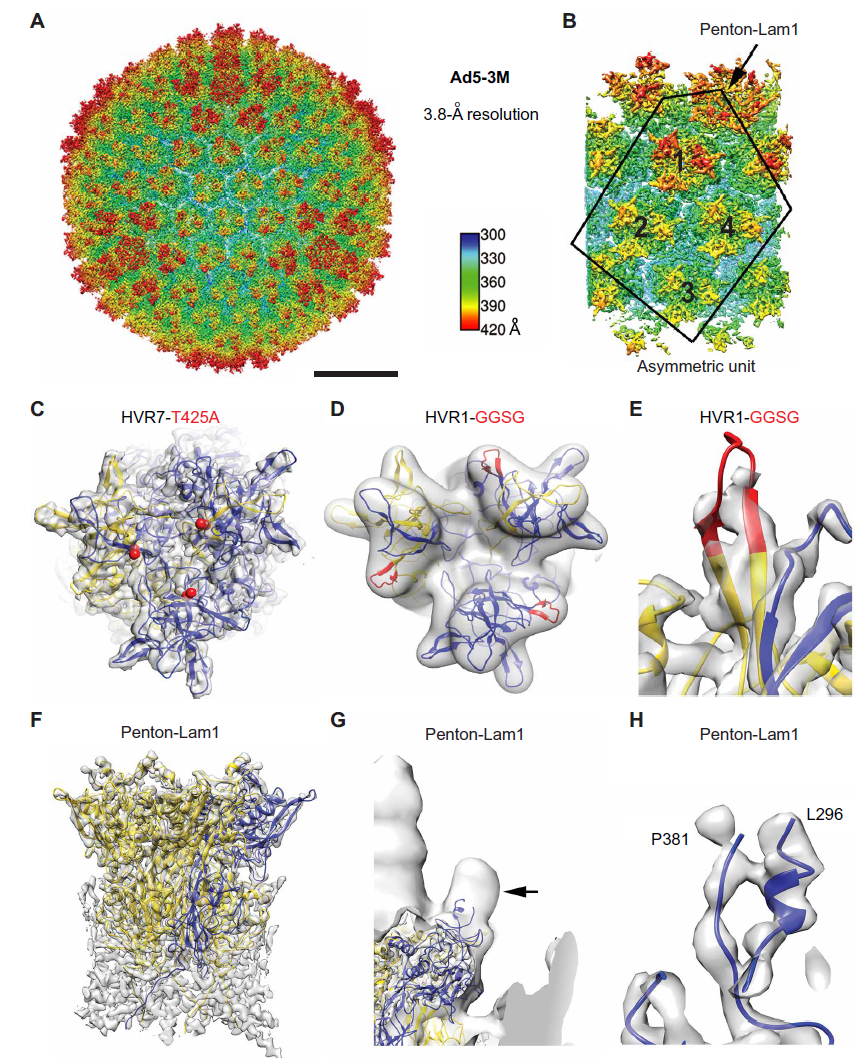
具体来说,Shayakhmetov博士及其合作伙伴首先发现天然IgM抗体是与主要的人类腺病毒HAdv-C5衣壳蛋白hexon的高变区1 (HVR1)结合。基于此,利用靶向诱变,研究人员对腺病毒进行了3处修改,获得了一种改良版的腺病毒——Ad5-3M。Ad5-3M包含3个突变,1个在hexon HVR1环的突变可阻断病毒与IgM结合;1个在hexon HVR7环的突变可使病毒无法与凝血因子X结合,抑制凝血因子X依赖性肝细胞感染;1个penton-整合素重定向突变,使病毒不与巨噬细胞中的β3整合素相互作用,而与存在于上皮肿瘤细胞上的含其它β亚基的整合素结合。
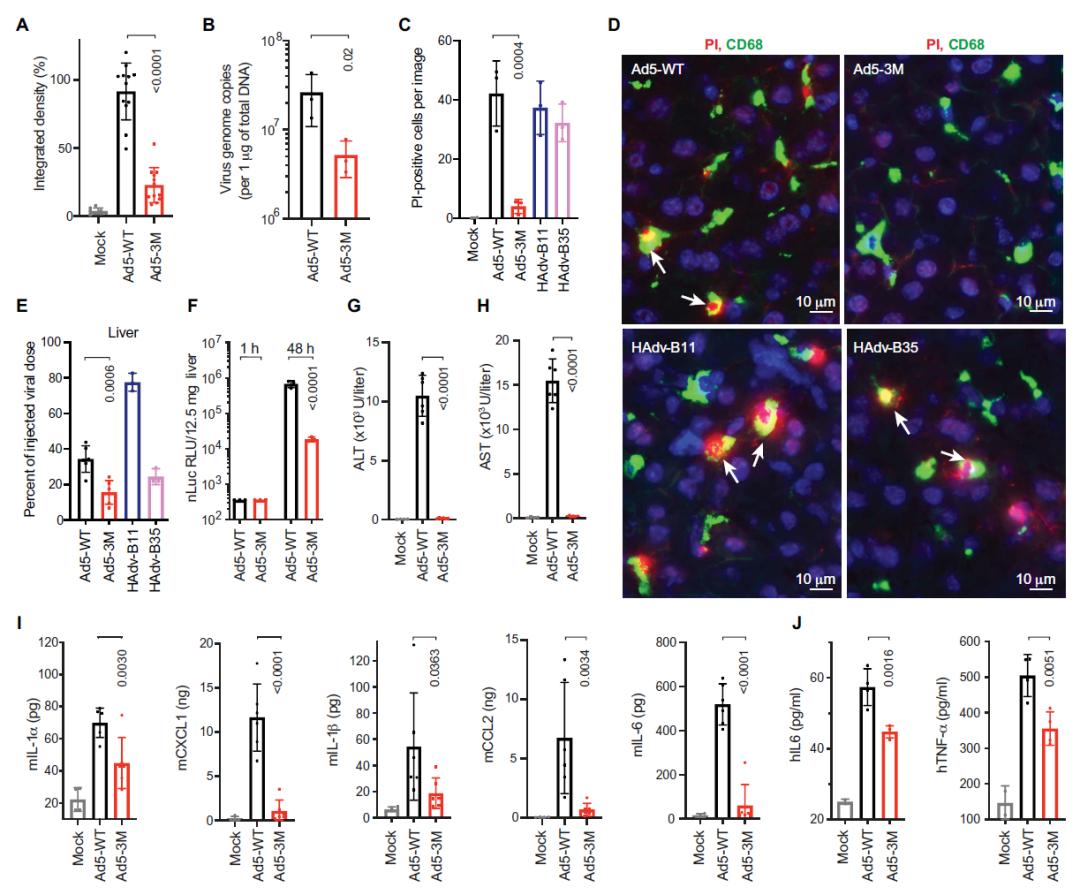
研究首次证实,通过在病毒中的IgM结合位点引入突变能够修改人类腺病毒(HAdv)与天然IgM的结合。Ad5-3M不仅可抵抗由血液因子导致的失活,避免被捕获到肝脏巨噬细胞中,且在静脉给药后未触发肝毒性。此外,Ad5-3M系统给药可导致病毒在肿瘤细胞中复制。
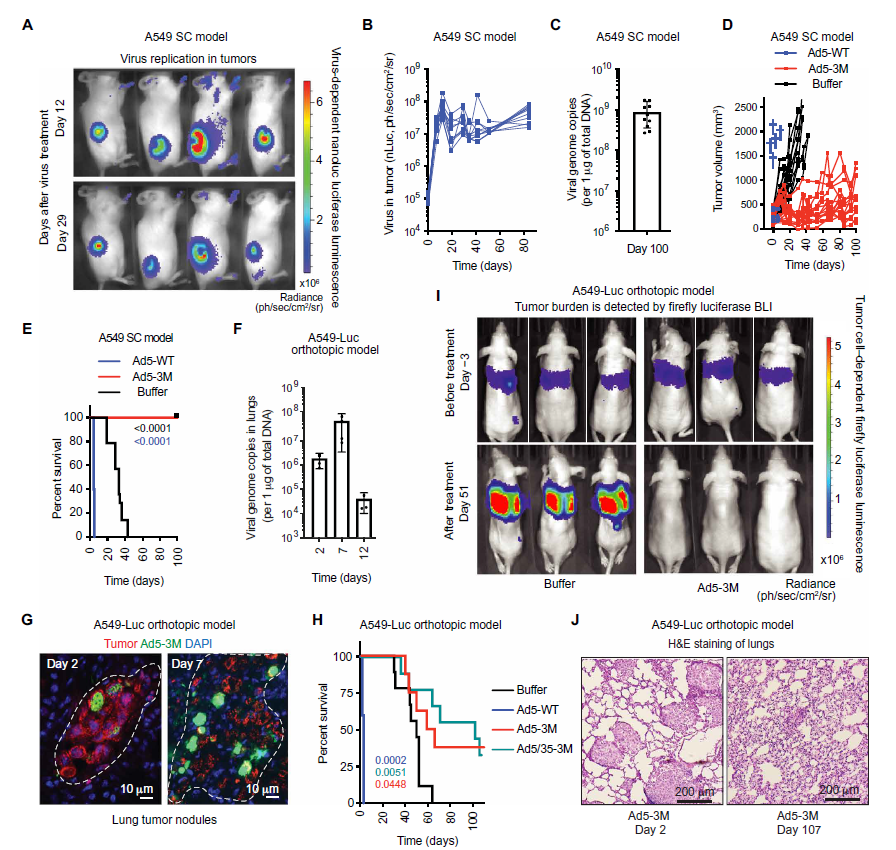
抗癌疗效评估显示,高剂量的标准腺病毒被注射到小鼠中会在触发肝损伤,且小鼠会在几天内死亡。相比之下,改良版的腺病毒Ad5-3M能够清除一些移植了人类肺癌细胞的小鼠身上的扩散性肿瘤。大约35%的动物出现了完全缓解(不再能检测到肿瘤),且生存期延长。
科学家们认为,以上结果表明,工程改造病毒使之能够逃避先天免疫系统“攻击”,有望为开发对现有治疗方式耐药的人类癌症的系统递送病毒疗法提供了一种可推广的方法。
“长期以来,当溶瘤病毒通过静脉注射递送时,先天免疫系统都会快速有效地将病毒送到肝脏中。这使得大多数溶瘤病毒通过瘤内注射直接被递送到肿瘤中,从而限制了其对转移性肿瘤的作用。而我们的研究揭示,通过系统递送足够高剂量的改良版溶瘤病毒达到抑制肿瘤生长,且不触发危及生命的系统性毒性的效果是可能的。” Shayakhmetov博士总结道。
据悉,Shayakhmetov博士在2016年已经创办了一家名为AdCure Bio的公司,致力于开发安全有效的实体瘤溶瘤病毒疗法,接下来,其团队将进一步探索如何提高修改版腺病毒疗法的完全缓解率。 点 评
复诺健 联合创始人兼首席科学家 贾为国博士

-
研究亮点与不足
最新发表在Science Translational Medicine杂志上的这项研究的主要创新点是对于常用于溶瘤病毒的5型腺病毒的衣壳(capsid)上的Hexon 和penton蛋白同时做了3处改造,其目的是在3方面降低病毒的非特异性免疫原性:1)取消与IgM 的结合;2)取消与凝血因子X的结合;3)阻止与beta3 integrin结合并转为与上皮肿瘤细胞高表达的其他integrin结合。这是因为IgM 与腺病毒的结合可能促进了病毒被肝内的kupffer 细胞吞噬,而凝血因子X和beta3 integrin与腺病毒结合介导了该病毒的肝毒性。经过上述改造后的腺病毒hAd5-3M在血液中的灭活率有明显改善,并且显示了静脉注射在免疫缺陷小鼠上对肿瘤细胞株和PDX肿瘤的疗效。这个研究似乎较好地解决了腺病毒系统给药的肝毒性问题。遗憾的是,对于腺病毒的静脉给药这些改造可能仍然不够。首先血液中抗腺病毒抗体的中和作用仍然没有解决,其次到达肿瘤的腺病毒复制活性是否能够抵抗其他免疫因素造成的病毒清除(例如T细胞、NK细胞等)还不清楚。该研究用免疫缺陷的荷瘤小鼠证明hAd5-3M 系统给药的溶瘤活性显然是不足以说明问题的,他们需要在免疫健全的小鼠或者人源化小鼠的肿瘤模型上才能证明静脉注射的真正有效性。当然,该研究对腺病毒的衣壳蛋白进行的基因改造,无论在病毒学的基础研究方面还是溶瘤病毒的应用前景方面都是有重大意义的。
-
扎根溶瘤病毒多年
溶瘤病毒这类“以毒攻毒”的抗癌疗法真正引起科学界的关注是在上世纪90年代初。我在加拿大UBC做博士后研究时,就开始了溶瘤病毒的研究。自1994年发表了第一篇文章以来,我一直在大学从事溶瘤病毒的研究。基于这些研究基础,2015年,我与合作伙伴在加拿大共同成立了专注于溶瘤病毒疗法开发的生物技术公司复诺健(ViroGin),公司不久前刚刚完成了6000多万美金的C轮融资。目前,我们的第一个产品VG161在澳大利亚和中国均已进入临床I期试验。VG161是以减毒骨架为基础的HSV-1病毒,携带IL12、IL15、IL15 alpha受体亚基,以及PD-L1 阻断多肽四个基因。公司的第二代产品是基于不减毒的骨架,通过转录翻译双重调控的方法保障了病毒的肿瘤特异性,在高度安全性的同时,具有很强的溶瘤活性。在这个骨架上,我们的产品管线有携带各种外源因子的病毒,未来几代的产品将在明年陆续进入临床阶段。
-
新一代溶瘤病毒开发
目前,在我看来,溶瘤病毒领域的关键障碍并不是静脉注射。因为其实现有的肿瘤外科和介入影像学技术已经使得瘤内注射在临床上不是一个主要的障碍了。更重要的是,T-VEC和其他一些正在开展临床试验的溶瘤病毒都已经证明,局部病毒注射是可以产生全身效应,造成远端肿瘤消失的。在此前提下,我认为溶瘤病毒的最终目的是将病毒诱导的机体的抗病毒免疫反应变为持久的抗肿瘤免疫反应。为了达到这个目的,新一代溶瘤病毒开发的主要目标是:1)在保证安全的前提下,具有足够的溶瘤活性,从而能够释放足够多的肿瘤抗原,实现在强烈的免疫激活背景上的抗原扩散(antigen spread),使得机体的免疫系统对肿瘤抗原产生免疫反应;2)溶瘤病毒在瘤内的生存时间不长,因此必须在有限的时间内,在肿瘤内产生一个“微型”的细胞因子风暴,因此携带什么样的外源因子能够与病毒感染本身诱导产生的多个免疫相关因子起到协同的作用是需要认真研究的;3)除了放疗之外,目前常规的抗肿瘤方法都是系统给药的,它们对全身免疫系统的影响是不一样的。有的可能有助于溶瘤病毒所诱导的抗肿瘤免疫反应,有的则可能会拮抗溶瘤病毒疗法。如何将溶瘤病毒所改变的肿瘤微环境与这些疗法有机地结合起来达到最大的疗效是一个需要摸索的方向。
-
未来3-5年展望
总体来说,我认为,溶瘤病毒领域目前处于临床突破的前夕。从1990年代开始的第一波溶瘤病毒,目前除了T-VEC和中国的H101之外,其它候选疗法都在临床III期以内,少有单药使用明显有效的。因此这一代的溶瘤病毒的主要出路在于和其他免疫治疗药物的联用。而T-VEC之后的新一代溶瘤病毒在病毒的溶瘤活性,刺激抗肿瘤免疫的能力方面都有了明显的提高。这一代病毒目前大都刚刚在I期或者II期临床阶段,因此需要待以时日才能见分晓。我乐观地估计在未来3-5年会有几个单药有效率高于T-VEC的新品种脱颖而出。与此同时,溶瘤病毒与其他药物的联用,特别是由于能够大幅提高免疫哨卡抑制剂的疗效,在此方面也将呈现一波热潮。
参考资料:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#STM#
46
学习了
90