CDE和注册司专家发文:基于风险的监查(RBM)应用和挑战
2018-08-16 苏娴,崔孟珣 中国新药与临床杂志
作者:苏娴a,崔孟珣b(国家食品药品监督管理总局 a.药品审评中心,b.药品化妆品注册管理司,北京 100038) 来源:中国新药与临床杂志 2018年6月 第37卷第6期 摘要:本文结合国际人用药品注册技术要求协调会(ICH)及美国食品和药物管理局(FDA)关于基于风险的监查(RBM)的指南,概述RBM的目的及在不同类型临床试验中的应用,介绍目前实施RBM方法的流程,包括
作者:苏娴a,崔孟珣b(国家食品药品监督管理总局 a.药品审评中心,b.药品化妆品注册管理司,北京 100038) 来源:中国新药与临床杂志 2018年6月 第37卷第6期 摘要:本文结合国际人用药品注册技术要求协调会(ICH)及美国食品和药物管理局(FDA)关于基于风险的监查(RBM)的指南,概述RBM的目的及在不同类型临床试验中的应用,介绍目前实施RBM方法的流程,包括鉴别需要监查的关键数据和程序、风险评估、制定监查计划时需要考虑的因素和监查计划,并探讨应用RBM面临的挑战。RBM作为现代的基于风险的方法,关注临床研究中的关键数据和流程,可有效地提高数据可靠性和受试者安全,但应用时应充分考虑临床试验特点,并可结合多种监查方法。 关键词:基于风险的检查;关键数据和流程;监查计划 临床试验数量的增多和设计复杂性会带来实施中的挑战,如当地的法规要求及临床试验的区域分布等方面的差异加大、方案依从性的困难增加等。过度关注单个数据传统监查模式不仅会使制药企业和合同研究组织(CRO)负担过重,更有可能不能及时或很难发现临床试验中质量的系统性问题和数据可靠性问题。鉴于此,基于风险的监查(risk-
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言





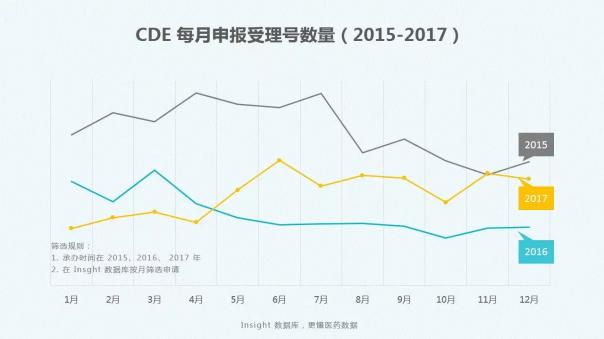


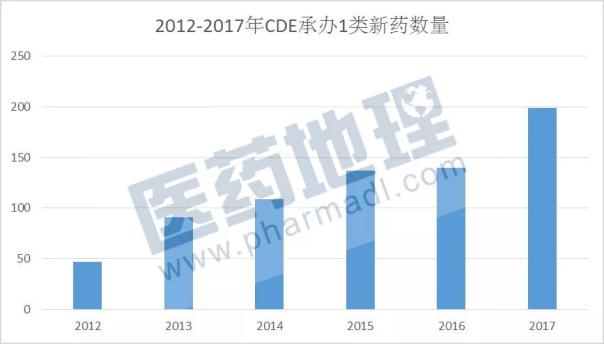





学习了
75
#注册#
30
不错的文章值得拥有哦
86