Nature子刊:上海药物所徐华强/吴灿荣揭示配体介导的前列腺素F2α受体激活以及与G蛋白偶联的分子机制
2023-05-12 iNature iNature 发表于上海
目前已经有包括拉坦前列素 (Latanoprost, LTP) 和他氟前列素 (Tafluprost, TFP)在内的几种 FP 选择性前列腺素类似物 (PGA)被美国食品和药物管理局 (FDA)批准
前列腺素是一类含氧花生四烯酸代谢物,包括前列腺素 F2α (PGF2α)、前列腺素 D2 (PGD2)、前列腺素 E2 (PGE2)、血栓素 A2 (TXA2) 和前列环素 (PGI2)。它们通过直接作用于包括前列腺素 F2α 受体(prostaglandin F2α receptor, FP)在内的九种脂类G 蛋白偶联受体 (GPCRs),在人体内发挥多种生物学功能(图1)。在激动剂的刺激下,激活的FP 主要与Gq 亚型偶联,从而导致随后的 PKC 激活和钙信号转导以响应三磷酸肌醇的形成(IP3)(图1)。FP的激活在调节炎症、过敏反应、眼内压和血压方面发挥着关键作用,使其成为重要的药物靶点。FP选择性激动剂已被开发用于治疗青光眼、斑秃和白癫风。
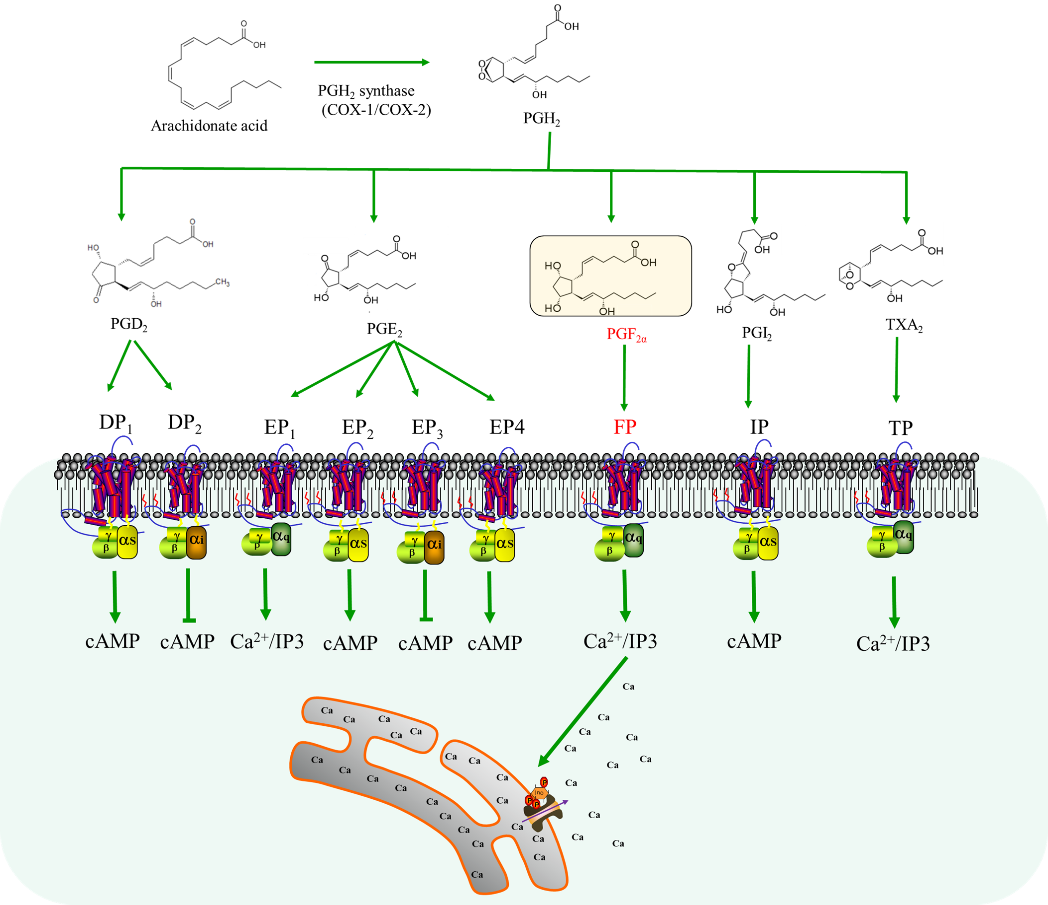
图1. 前列腺素的生物合成以及其作用于前列腺素受体的信号转导模式。
目前已经有包括拉坦前列素 (Latanoprost, LTP) 和他氟前列素 (Tafluprost, TFP)在内的几种 FP 选择性前列腺素类似物 (PGA)被美国食品和药物管理局 (FDA)批准用于治疗青光眼。前列腺素类似物作为治疗青光眼的基础用药,临床运用普遍。但这些药物的高的不良反应发生率仍然不容忽视,开发出更具选择性的药物是降低其副作用的关键。然而,由于FP与其配体复合物等关键结构的缺失,有关配体选择性识别FP的模式,以及FP激活机制和G蛋白偶联的分子机制等关键科学问题尚未解决,这也极大的阻碍了高选择性FP激动剂药物的开发进程。
2023年5月9日,中国科学院上海药物研究所徐华强/吴灿荣团队与合作者共同在Nature Communications发表了最新的研究成果“Ligand-induced activation and G protein coupling of prostaglandin F2α receptor”。本研究利用冷冻电镜技术解析了内源性配体PGF2α 以及两种药物结合人类前列腺素F2α受体-Gq复合物结构,分辨率分别为2.67 Å、2.78 Å 和 3.14 Å(图2)。

通过结构揭示了脂质受体家族中 FP 的配体选择性识别、激活和偶联G 蛋白机制方面的独特特征。包括了拉坦前列素酸 (LTPA) 和他氟前列素酸(TFPA)相对于内源性配体PGF2α 对FP具有更高选择性分子机制,在没有典型 PIF 和 ERY 基序的情况下的激活机制以及通过受体TM1和ICL1直接作用偶联Gαq蛋白。结合突变和功能研究,这些结构揭示了 FP 的选择性配体识别和独特的受体激活和 G 蛋白偶联机制,以促进FP选择性药物的设计。
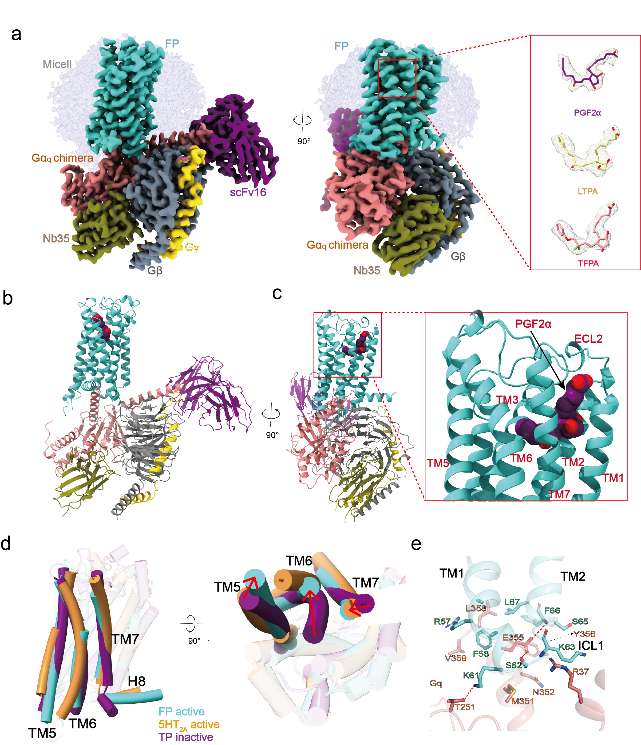
图2. FP-Gq与配体复合物的冷冻电镜结构。a-c. 三种配体与FP-Gq复合物结构。d. FP独特的激活状态结构;e. FP 的TM1,TM2和 ICL1 与Gαq蛋白的相互作用分析。
本研究中的冷冻电镜数据在上海市高峰电镜中心收集。上海药物所吴灿荣博士和徐有伟副研究员为该论文的共同第一作者;上海药物所徐华强研究员和吴灿荣博士为共同通讯作者。上海药物所为本研究的第一完成单位。该工作获得了包括国家自然科学基金委、科技部重大专项,以及上海市市级科技重大专项等项目的资助。
原文链接:
https://www.nature.com/articles/s41467-023-38411-x
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








