加速与ICH接轨《个例安全性报告E2B(R3)区域实施指南》 发布
2019-11-26 佚名 CPhI制药在线
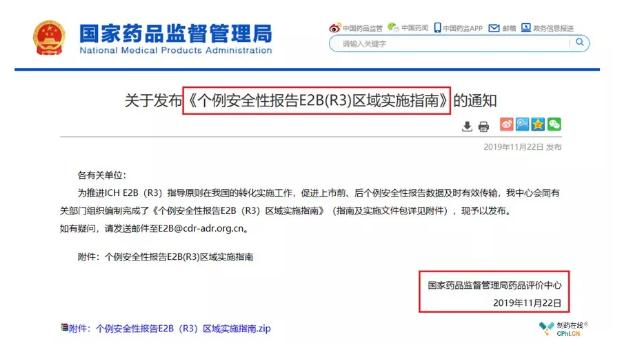
2019年11月22日,各大朋友圈、网络平台被一则"国家药监局药品评价中心发布了《个例安全性报告E2B(R3)区域实施指南》的通知"的消息刷屏,让我们再次看到了国家药监局加速与ICH接轨的决心与行动,本文为大家梳理了个例安全性报告规范(ICH E2B(R3))相关知识点。

2019年11月22日,各大朋友圈、网络平台被一则"国家药监局药品评价中心发布了《个例安全性报告E2B(R3)区域实施指南》的通知"的消息刷屏,让我们再次看到了国家药监局加速与ICH接轨的决心与行动,本文为大家梳理了个例安全性报告规范(ICH E2B(R3))相关知识点。
一、国际如何布局实施ICH E2B
国际人用药品注册技术协调会(简称ICH),作为药品领域极其重要的国际组织,主要是协调各国的药品注册技术要求,使药品生产厂家能够应用统一的注册资料,提高新药研发、注册、上市的效率,个例安全性报告是目前发现药品不良反应信号的主要来源之一,如果没有一个统一的标准,个例安全性报告将会五花八门,杂乱无章,ICH详细规范了临床安全性数据管理细则ICH E2B,以期指导不同国家个体病案安全性报告规范。
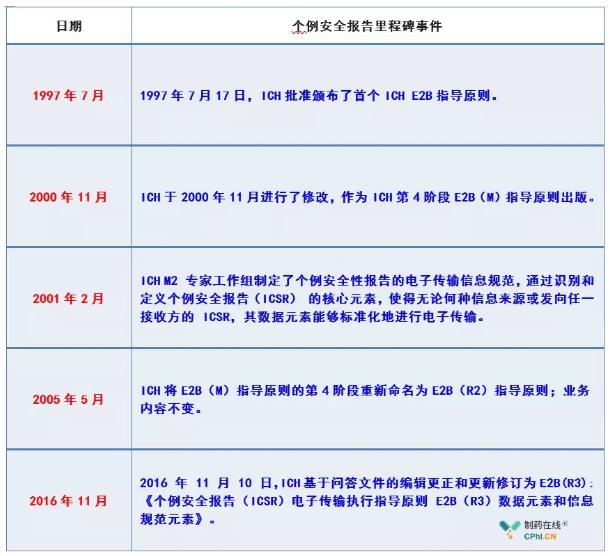
二、中国如何布局实施ICH E2B
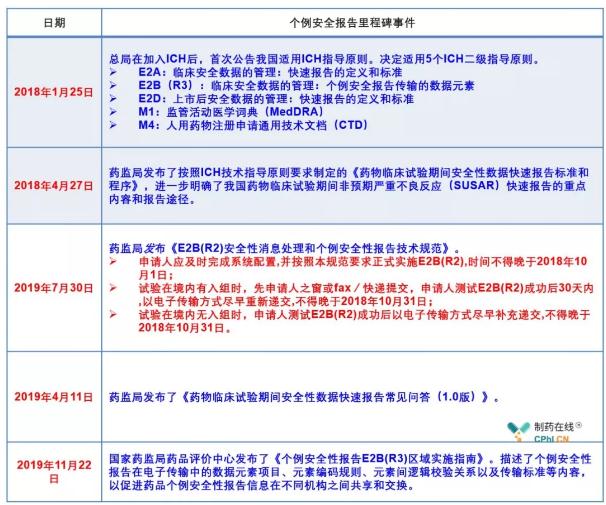
三、《个例安全性报告E2B(R3)区域实施指南》常见问答
2019年11月22日,国家药监局药品评价中心同步发布了《个例安全性报告E2B(R3)区域实施指南问答文件》,是对实施指南内容的补充,常见问题和解读如下:
2.1 采用哪种形式报告境外严重报告?
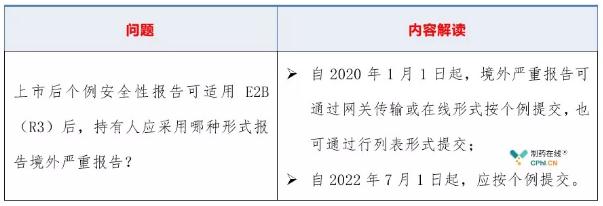
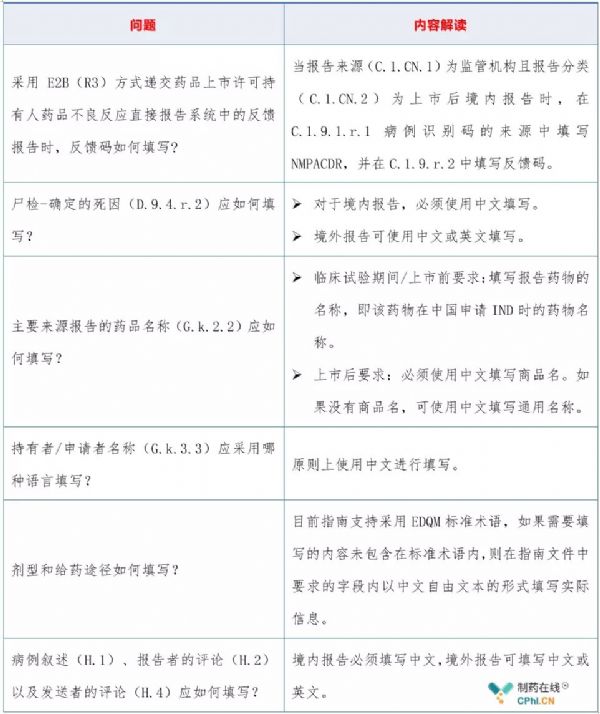
2.2 如何填写个例安全性报告?
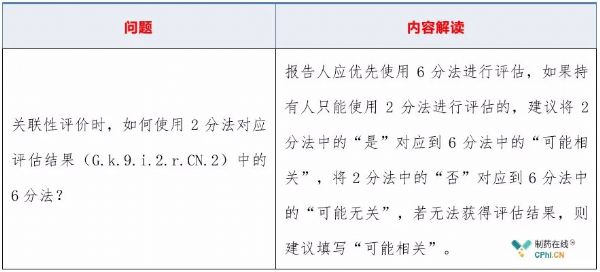
2.3 关联性如何评价?
2.4 如何配置?如何处理传输异常?

小提示:本篇资讯需要登录阅读,点击跳转登录
版权声明:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#ICH#
38