Nature Biotechnology:新型基因编辑工具PASTE,无需DNA双链断裂,实现定点插入超大片段基因
2022-11-27 王聪 “生物世界”公众号 发表于上海
上述的分子克隆实验通常是在原核生物中进行的(例如细菌),但涉及真核生物基因组的操作,特别是几千个核苷酸长度的DNA序列的整合,仍然十分具有挑战性。
生命科学的飞速发展,为科学家自由操纵基因提供了前所未有的简便和高效。在分子生物学实验室里,你可以很方便地通过聚合酶链式反应(PCR)将一个基因克隆下来,并连接到相应的表达载体(质粒)上。
遗憾的是,上述的分子克隆实验通常是在原核生物中进行的(例如细菌),但涉及真核生物基因组的操作,特别是几千个核苷酸长度的DNA序列的整合,仍然十分具有挑战性。这也限制了合成生物学、细胞工程和基因治疗等新兴领域的发展。
2022年11月24日,麻省理工学院的 Omar Abudayyeh、Jonathan Gootenberg 等人在 Nature Biotechnology 期刊发表了题为:Drag-and-drop genome insertion of large sequences without double-strand DNA cleavage using CRISPR-directed integrases 的研究论文。
该研究在 CRISPR 的基础上开发了一种名为 PASTE 的新技术,能够以更安全、更有效的方式替换突变基因,可向哺乳动物及人类细胞中定点插入长达36000个碱基的DNA长片段。

《生物世界》采访了该论文的作者姜凯议,姜凯议本科毕业于美国莱斯大学,目前是 Omar Abudayyeh 和 Jonathan Gootenberg 实验室的博士二年级学生。就在最近,姜凯议作为第一作者或共同第一作者在 Nature Biotechnology 和 Science 各发表一篇论文,前者开发了一款基于ADAR的可编程RNA传感器;后者解析了可以切割蛋白质的CRISPR系统Cas7-11的结构和作用机制,并将其应用于可编程的RNA传感。

姜凯议
CRISPR-Cas9基因编辑系统,是由Cas9酶(负责切割DNA双链)和gRNA(负责识别和靶向目标基因组特定位点)组成,gRNA引导Cas9到达基因组的特定位点并指导Cas9切割DNA双链。当Cas9和靶向致病基因的gRNA被递送到细胞中时,会切割致病基因的特定位点,造成DNA双链断裂(DSB),细胞随后启动DNA修复过程,但这种修复过程会出现错误,从而实现对致病基因的敲除。
如果在Cas9切断DNA双链时,同时递送一段DNA模板,细胞在修复过程中就可能将这段DNA模板整合进基因组。但这一过程依赖于DNA双链断裂,这可能会导致有害的染色体缺失、重排、碎裂等等。而且这一过程通常只在分裂细胞中起作用,因为不分裂细胞没有活跃的DNA修复过程。
该研究调的希望能开发出一种新工具,能够在不不引起DNA双链断裂的情况下,去除并替换有缺陷的基因。为了实现这一目标,他们将目光放在了整合酶上,这是一类来自病毒(噬菌体)的酶家族,噬菌体利用整合酶将自己的基因组插入到宿主细菌基因组中。
PASTE——粘贴
在这项研究中,研究团队专注于丝氨酸整合酶,它可以插入大片段DNA序列,最长可达5万个碱基对。这些整合酶的目标是被称为附着位点的特定基因组序列,它起着“着陆垫”的作用。当整合酶在宿主基因组中找到正确的附着位点时,就会与之结合,然后将携带的DNA片段整合进去。
然而,将这些整合酶应用于人类基因治疗很有挑战性,因为它们在基因组上的附着位点很特定,很难对整合酶进行重编程以定位到其他位点。
Omar Abudayyeh、Jonathan Gootenberg 团队意识到,CRISPR-Cas9能够靶向特定位点,将其与整合酶结合,有望实现可编程的大片段基因插入。
基于上述想法,研究团队开发了一种名为PASTE(Programmable Addition via Site-specific Targeting Elements)的新工具。该新工具包含Cas9切口酶(只切断DNA一条链,而不造成DNA双链断裂),它在gRNA的引导下切割特定基因组位点,此时Cas9切口酶融合的逆转录酶将整合酶所需的附着位点序列整合进切割位点。通过这种方式,就可以将整合酶所需的附着位点插入基因组中的任何位置,而且这种插入不引起DNA双链断裂,此时,整合酶就可以与附着位点结合,将大片段DNA序列插入。

PASTE技术原理
注:Programmable Addition via Site-specific Targeting Elements(基于位点特异性靶向元件的可编程添加),简称PASTE,PASTE这个词本身有粘贴、插入的意思。
Jonathan Gootenberg 表示,这项研究是实现可编程的DNA大片段插入梦想的一大步,通过这一技术可以很容易地根据需要定制附着位点和整合DNA片段。
从上述技术原理来看,PASTE很容易让人想到刘如谦团队开发的先导编辑(Prime Editor),在先导编辑的Cas9切口酶和逆转录酶的基础上融合了丝氨酸整合酶,相当于使用先导编辑先在基因组中插入丝氨酸整合酶的附着位点,然后通过丝氨酸整合酶来插入大片段DNA。
刘如谦团队于2021年12月在 Nature Biotechnology 期刊发表了题为:Programmable deletion, replacement, integration and inversion of large DNA sequences with twin prime editing 的研究论文。
刘如谦团队开发了升级版的先导编辑(Prime Editor),将其命名为——双先导编辑(Twin Prime Editing,TwinPE)。TwinPE同样不会导致DNA双链断裂,通过一个先导编辑蛋白(prime editor protein)和两个向导RNA(pegRNA),可实现对人类基因组的可编程的大片段DNA的删除、替换、整合和倒位。
姜凯议告诉《生物世界》,实际上,先导编辑(Prime Editor)中的Cas9切口酶和逆转录酶不一定非要融合在一起,分开递送也同样可以发挥作用甚至效果更好。团队也已经申请了将Cas9切口酶和逆转录酶分开发挥作用的相关专利。而且,对于大片段DNA插入来说,PASTE的效率要比TwinPE更高。
实现大片段DNA的定点插入
在这项研究中,研究团队使用PASTE技术将DNA片段插入了包括肝细胞、T细胞和淋巴母细胞等人类细胞中,研究团队测试了13个不同的DNA片段,其中包括一些具有治疗意义的基因,能够将它们插入到基因组中的9个不同位点。
在人类细胞中,PASTE将DNA片段成功插入基因组的效率在5%-60%之间,而且很少在插入位点引入不需要的Indel(插入或缺失突变)。Omar Abudayyeh 表示,很少看到Indel,是因为PASTE没有造成DNA双链断裂,因此不必担心染色体重排或染色体缺失等潜在副作用。
研究团队还在“人源化”的小鼠模型中进行了测试,他们发现,PASTE能够在这些小鼠肝脏中插入基因。这些小鼠的肝脏由大约70%的人类肝细胞组成,而PASTE成功地将新基因整合到2.5%的这些细胞中。
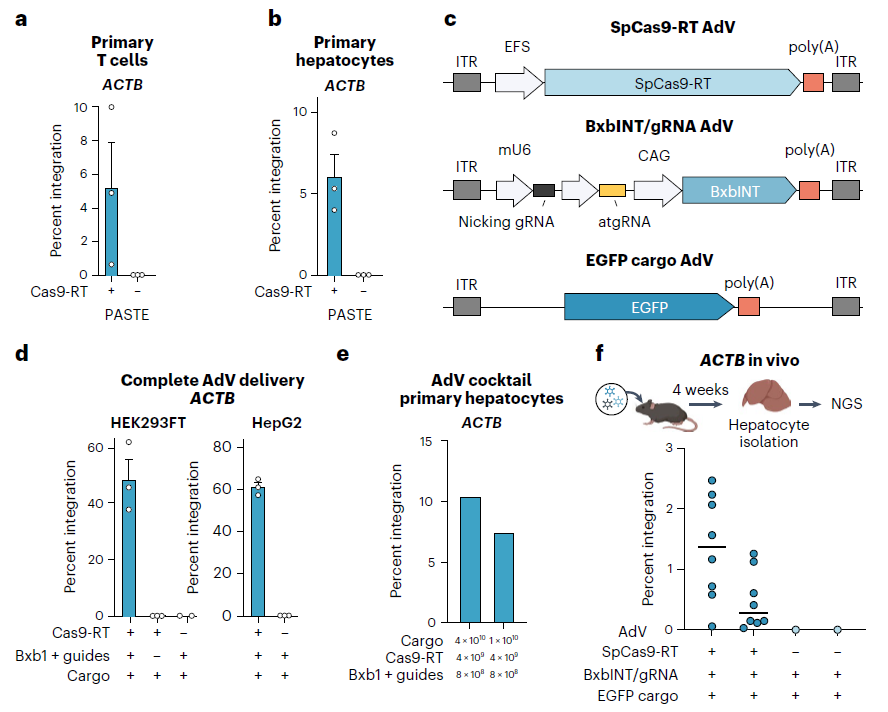
在这项研究中,研究团队最长插入了36000个碱基对的DNA序列,但他们表示还可以更长。人类基因的碱基对从几百个到200多万个不等,但在治疗中只需要使用其中编码蛋白质的序列,也就是外显子序列即可,这大大减少了所需插入的DNA片段的大小。
2022年10月,弧光研究所(Arc Institute)的 Patrick Hsu 团队在 Nature Biotechnology 期刊发表了题为:Systematic discovery of recombinases for efficient integration of large DNA sequences into the human genome 的研究论文。该研究开发了一种算法识别了数千种丝氨酸整合酶及其DNA附着位点,将已知丝氨酸整合酶的多样性扩大了100倍。这些整合酶可以将超过7kb的大型DNA片段精准、高效地插入人类基因组。
姜凯议表示,大量识别新的丝氨酸整合酶及其附着位点是利用整合酶进行大片段DNA插入的一种思路,但是绝大部分的丝氨酸整合酶对人类细胞而言是有毒的,这就导致了发现的大部分新的丝氨酸整合酶是不可用的。因此,人为向基因组导入附着位点的方式,能够几乎在基因组的任何位置利用丝氨酸整合酶插入大片段DNA。
这种新工具有望用于治疗由大量突变的缺陷基因引起的疾病,例如囊性纤维化。论文共同通讯作者 Omar Abudayyeh 表示,这项研究是朝着基因治疗最初应该做的方向努力,也就是替换基因,而不仅仅是修正单个突变。
据悉,Omar Abudayyeh、Jonathan Gootenberg 于2021年创立了一家名为 Tome Biosciences 的生物技术公司。研究团队正在进一步探索使用PASTE技术来替换有缺陷的囊性纤维化基因的可行性,此外,该技术可以用于治疗许多由基因突变引起的疾病,例如血友病、G6PD缺乏症、亨廷顿舞蹈症等等。
最后,姜凯议表示,对于大片段DNA的插入或替换而言,CRSIPR-Cas9可能并不是很好的工具,自然界中大量的可移动遗传元件,能够从中不断发现有趣、有用的新工具,是未来值得探索的方向。
总的来说,这些研究实现了在分裂和非分裂细胞中的高效、定点的大片段DNA插入,大大扩展了基因编辑的范围,为复杂基因缺陷疾病的治疗提供了新的工具,同时也为CAR-T等细胞疗法提供了新的工具。
原始出处:
Yarnall, M.T.N., Ioannidi, E.I., Schmitt-Ulms, C. et al. Drag-and-drop genome insertion of large sequences without double-strand DNA cleavage using CRISPR-directed integrases. Nat Biotechnol (2022). https://doi.org/10.1038/s41587-022-01527-4.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












