肿瘤抗原诱导的T细胞耗竭:免疫“热”肿瘤的大敌
2022-07-30 小药说药 网络
减少或控制TME中T细胞功能障碍的负面影响的可能治疗选择包括使用同时针对多个共同抑制信号或受体的联合疗法,使用基因修饰(例如,抗耗竭)的肿瘤抗原特异性T细胞的过继性细胞疗法,或调节IL-7途径。
实体瘤是在复杂的肿瘤微环境中发生和发展的,高水平的肿瘤浸润淋巴细胞(TIL)通常与良好的预后结果相关。然而,效应T(Teff)细胞可能暴露于来自TME的免疫调节信号和可影响转录和表观遗传的连续抗原刺激。这种暴露会限制其活性,并导致一种称为T细胞耗竭的功能障碍。
Teff细胞功能障碍包括多种T细胞特征,如分化和细胞溶解特性改变,增殖和死亡程序失调以及多种免疫抑制信号(如PD-1、LAG-3、TIM-3、TIGIT和CD39)的表达增加。最近的研究利用单细胞策略探讨了人类黑色素瘤和肺癌中肿瘤抗原特异性效应T细胞的功能特性和临床意义。这些发现扩大了我们对肿瘤微环境中T细胞改变的理解,并证明CD8+T细胞耗竭是通过暴露于肿瘤细胞特异性抗原介导的,并且与组织驻留记忆表型相关。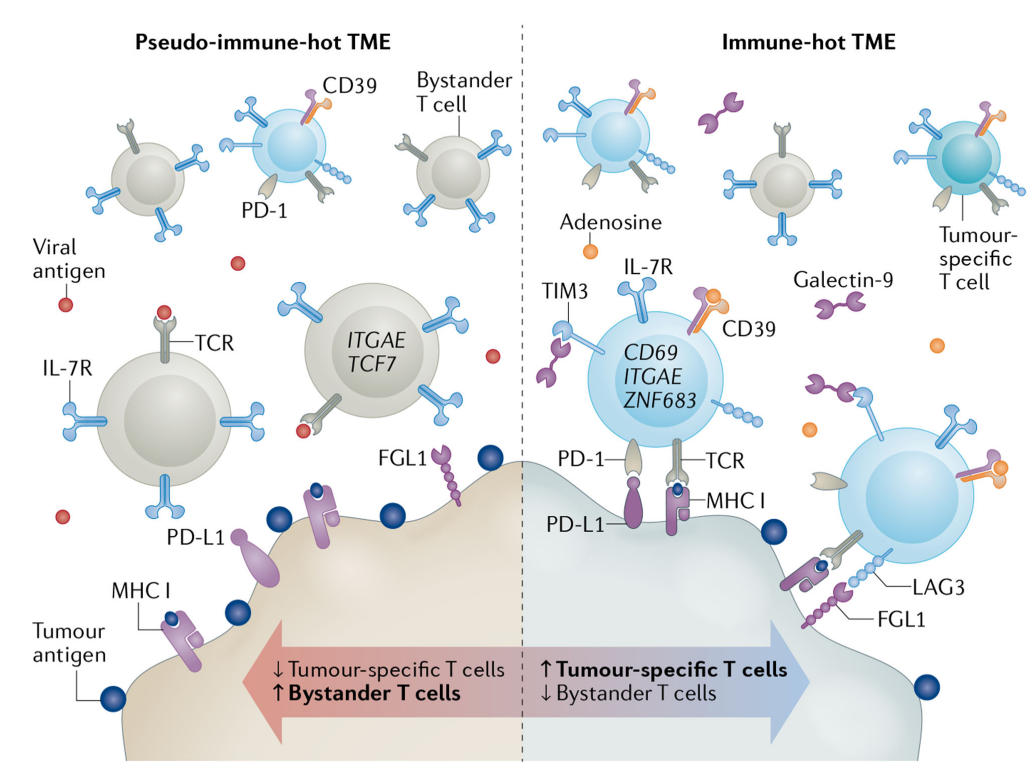
一项研究评估了四名手术切除黑色素瘤患者的肿瘤抗原特异性CD8+Teff TIL中的单细胞转录谱、T细胞受体(TCR)库和选定的表面蛋白。根据优势Teff克隆型的分布,最终将其分为两个功能类别:耗竭细胞和非耗竭记忆细胞。扩增最多的TCR克隆型的CD8+Teff细胞主要具有耗竭的特征,并表达与组织驻留记忆(TRM)细胞相关的转录物,例如ITGAE(编码CD103)和ZNF683。
此外,当导入无癌个体的T细胞时,大多数(83%)来自耗竭的CD8+Teff细胞的TCR克隆对癌细胞具有自体反应性,而来自未耗竭细胞的TCR只有10%具有反应性。大多数从TIL分离的TCR识别一种或多种具有共同HLA限制的肿瘤特异性抗原。在一项研究的14例黑色素瘤患者中,初始外周血样本中耗竭的肿瘤抗原特异性CD8+Teff细胞很少见,但在ICIs治疗后进展的患者中可以检测到更多的此类细胞,这些耗竭的细胞特征性地表达高水平的PD-1和CD39。
总之,这些结果表明,肿瘤抗原特异性Teff细胞具有耗竭的功能特征,这种状态的获得是由持续暴露于肿瘤抗原驱动的。这些结果与之前的研究一致,表明肿瘤抗原特异性与其他恶性肿瘤患者TIL中的Teff细胞耗竭密切相关。尽管这些研究也报告高丰度的未耗竭病毒特异性旁观者T细胞,但似乎对抗肿瘤反应没有贡献。
另一项研究分析了20例经nivolumab新辅助治疗的非小细胞肺癌患者的体外扩增肿瘤抗原特异性CD8+Teff细胞的单细胞转录组学特征和TCR序列。基于转录组学分析,共鉴定出15个T细胞簇,其中6个具有与TRM细胞一致的表达谱。大多数新抗原特异性CD8+Teff细胞克隆型被分配到不同的TRM细胞簇,其特征是效应功能不完整、免疫抑制信号增加、TRM标记物上调以及与T细胞耗竭相关的转录因子表达增加(PRDM1和TOX2)。这些特征在病毒特异性旁观者T细胞中未观察到。
总之,以上这些研究表明肿瘤抗原特异性细胞显示TRM表型,并显示耗竭或功能失调的特征。此外,与病毒特异性T细胞相比,新抗原特异性CD8+Teff细胞也降低了IL-7R的表达和对IL-7刺激的敏感性。这些研究扩大了我们对免疫“热”肿瘤中T细胞改变的理解,它们明确证明了CD8+Teff细胞耗竭是通过暴露于肿瘤细胞抗原介导的,并且与TRM表型显著相关。这些研究还证明存在不同水平的未耗竭旁观者细胞,其肿瘤反应性有限,生物功能不明确。大量的这些旁观者细胞的存在可能会产生假免疫“热”肿瘤,并降低对ICIs治疗的敏感性。
减少或控制TME中T细胞功能障碍的负面影响的可能治疗选择包括使用同时针对多个共同抑制信号或受体的联合疗法,使用基因修饰(例如,抗耗竭)的肿瘤抗原特异性T细胞的过继性细胞疗法,或调节IL-7途径。未来还需要进一步的研究,以确认这些发现的临床意义,扩大对TRM细胞在ICIs反应中作用的理解,并揭示肿瘤特异性T细胞功能失调的具体分子机制。
参考文献:
1. Tumour antigen-induced T cell exhaustion — the archenemy of immune-hot malignancies. Nat Rev Clin Oncol. 2021 Dec; 18(12): 749–750

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#肿瘤抗原#
40
#T细胞耗竭#
54
#抗原#
41