我们人类从哪里来?为何独一无二?系统解读新科诺奖得主斯万特·帕博的研究成果
2022-10-06 王聪 “生物世界”公众号
斯万特·帕博(Svante Pääbo)通过他的开创性研究,完成了一件看似不可能的事——对已灭绝数万年的人类近亲尼安德特人进行基因测序。他还发现了一种以前不为人知的古人类物种——丹尼索瓦人。
2022年10月3日,瑞典科学家斯万特·帕博因其在已灭绝的古人类基因组和人类进化方面的发现获得了本年度的诺贝尔生理学或医学奖,他的发现为人类免疫系统以及人类与已经灭绝的近亲(尼安德特人、丹尼索瓦人)相比的独特之处提供了关键见解。
人类总是对自己的起源充满兴趣。
我们智人从哪里来?
我们智人和之前的古人类有什么关系?
是什么让我们智人与其他古人类不同?
斯万特·帕博通过他的开创性研究,完成了一件看似不可能的事——对已灭绝数万年的人类近亲尼安德特人进行基因测序。他还发现了一种以前不为人知的古人类物种——丹尼索瓦人。
更重要的是,他的研究证实了在大约7万年前人类走出非洲后,与尼安德特人和丹尼索瓦人之间发生了基因流动,这些已灭绝的古人类物种的某些基因至今仍在现代人类身上。这些古老的基因影响着我们的对感染的免疫反应、适应高海拔环境的能力,甚至是生育能力。
他的这些开创性研究产生了一门新的学科——古基因组学(Paleogenomics),通过揭示现存人类与已灭绝的古人类物种之间的基因差异,为探索是什么使我们成为独一无二的人类奠定了基础。

斯万特·帕博今年67岁,他的父亲 Sune Bergstrom 因前列腺素相关研究获得了1982年的诺贝尔生理学或医学奖
虽然尼安德特人的骨骼在19世纪中期就首次被发现,但只有解开他们的DNA,科学家们才能够完全理解尼安德特人与现代人类这两个物种之间的联系。
斯万特·帕博率先开发了新技术,使得研究人员能够比较现代人类(智人)与其他古人类(尼安德特人、丹尼索瓦人)的基因组。
诺贝尔委员会主席 Anna Wedell 表示,斯万特·帕博的开创性发现为人类的进化史提供了重要的新知识。
我们从哪里来?
我们人类的起源,以及是什么使我们独一无二,这两个问题自古以来就困扰着人类。古生物学和考古学提供的证据表明,解剖学上的现代人类(智人,Homo sapiens)大约在30万年前首次出现在非洲。而我们已知的近亲尼安德特人(Homo neanderthalensis)则在非洲以外发展,尼安德特人在大约40万年前开始居住在欧洲和西亚地区,在大约3万年前他们灭绝了。
大约7万年前,智人群体从非洲迁移到中东地区,并从那里开始迁移到世界其他地方。因此,智人和尼安德特人在欧亚大陆的许多地区共存了数万年时间。
20世纪90年代末,人类基因组计划草图完成,人类的几乎整个基因组都被测序了,这一伟大成就为后续研究不同人类物种之间的遗传关系提供了条件。
然而,研究智人和已灭绝的尼安德特人之间的关系,需要对从古代标本中恢复的基因组DNA进行测序。
一个不可能完成的任务
在科研生涯的早期,斯万特·帕博(Svante P??bo)就对利用现代基因方法研究尼安德特人DNA的可能性非常着迷。然而,他很快就意识到技术上面临的极端挑战,因为随着时间的推移,DNA会发生化学修饰并降解为短片段。数千年后,将只剩下少量的DNA,剩下的大部分都被细菌和人类的DNA污染了。
作为进化生物学领域的先驱 Allan Wilson 的博士后,斯万特·帕博开始开发研究尼安德特人DNA的方法,这一努力持续了几十年。
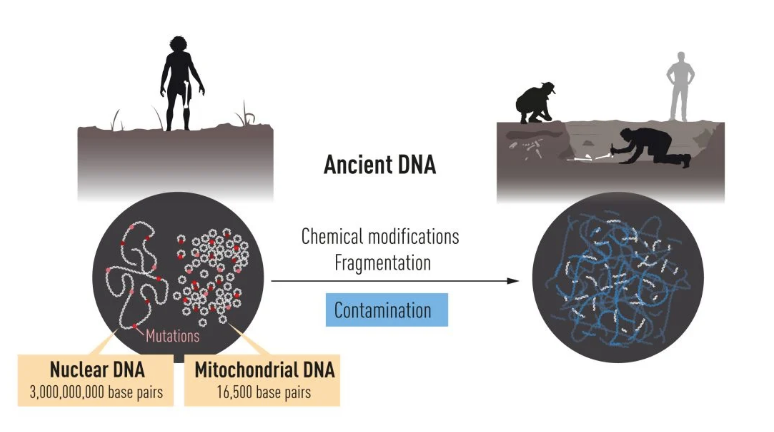
1990年,斯万特·帕博被慕尼黑大学录取为教授,在那里继续从事古DNA的研究工作。此时,他决定分析尼安德特人的线粒体DNA,线粒体基因组很小,只包含细胞遗传信息中的一小部分,但一个细胞中存在数千个线粒体,这增加了成功的机会。
通过改进方法,他成功地从一个4万年前的尼安德特人骨头中检测到了一段线粒体DNA序列。这是人类第一人获得已灭绝的近亲的基因序列。与现代人类和黑猩猩的比较显示,尼安德特人在基因上是不同的。
对尼安德特人基因组测序
线粒体基因组太小,对其分析也只能提供有限的信息,因此,斯万特·帕博对尼安德特人核基因组测序发起巨大挑战。他创立了马克斯·普朗克进化人类学研究所,并开始改进从古骨遗骸中分离和分析DNA的方法。
凭借技术的进步和关键合作者的共同努力,斯万特·帕博完成了这个看似不可能的任务,并在2010年发表了首个尼安德特人基因组序列。基因组序列对比分析表明,尼安德特人和智人最近的共同祖先生活在大约80万年前,此后尼安德特人和智人发展成为两个独立物种。
他们还调查了尼安德特人和来自世界不同地区的现代人之间的关系,对比分析表明,尼安德特人的DNA序列与来自欧洲或亚洲的同时代人类的DNA序列更相似,而不是来自非洲的同时代人类。这意味着尼安德特人和智人在共存中发生了通婚,产生了基因流动。在具有欧洲或亚洲血统的现代人类中,大约1-4%的基因组来自尼安德特人。
发现丹尼索瓦人
2008年,西伯利亚南部的丹尼索瓦洞穴中发现了一块4万年前的指骨碎片。这块骨头含有保存非常完好的DNA,斯万特·帕博(Svante P??bo)团队对其进行了测序。结果引起了轰动:与所有已知的尼安德特人和现代人类的DNA序列相比,这个DNA序列是独一无二的。因此,这是一个之前不为人知的新的古人类物种——丹尼索瓦人。
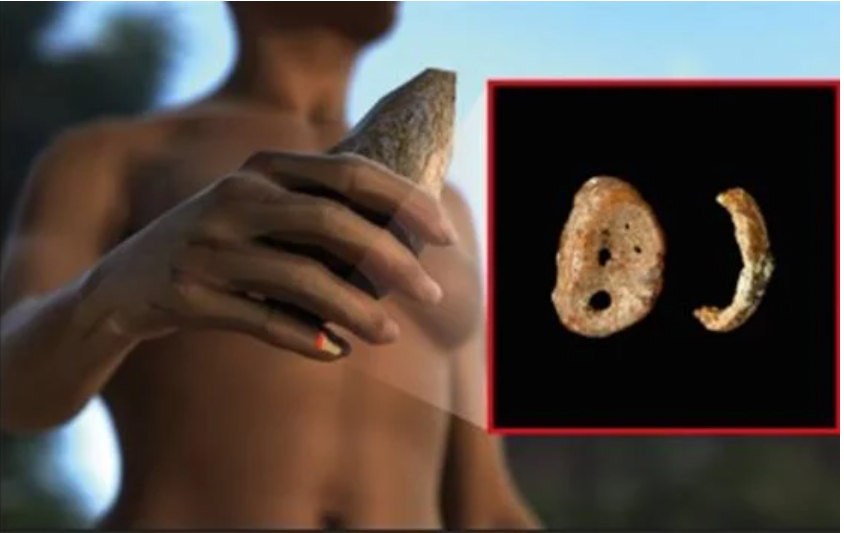
发现的丹尼索瓦人指骨碎片
这项发现轰动一时,随后的研究显示,明尼安德特人和丹尼索瓦人是大约60万年前从彼此分离出来的姊妹族群。而在亚洲和东南亚的现代人类中发现了高达6%的丹尼索瓦人基因,这表明丹尼索瓦人在那里与人类通婚,从而产生了基因流动。
这些研究发现让我们对人类进化史有了新的认知,当现代人类(智人)走出非洲时,当时的欧亚大陆至少有两个已灭绝的古人类物种,生活在欧亚大陆西部的尼安德特人和生活在欧亚大陆东部的丹尼索瓦人。在智人走出非洲后向世界迁移的过程中,他们与尼安德特人和丹尼索瓦人相遇并发生通婚,从中获得了提高了智人在新环境中生存机会的基因。例如,我国青藏高原地区的人类与丹尼索瓦人共享了一组帮助适应高海拔环境的基因。

开创全新学科——古基因组学
通过开创性的研究,斯万特·帕博(Svante P??bo)建立了一门全新的科学学科——古基因组学(Paleogenomics)。
在最初的发现之后,他的团队完成了对已灭绝古人类几个基因组序列的分析。这些发现建立了一个独特的资源,被科学界广泛利用,以更好地理解人类的进化和迁移。
要感谢斯万特·帕博(Svante P??bo)的发现,让我们了解到,来自人类已经灭绝的近亲(尼安德特人、丹尼索瓦人)的古老基因序列仍在影响着当今人类的生理机能。
例如丹尼索瓦人的EPAS1基因,它赋予了在高海拔地区生存的优势,这一基因在现在的中国藏族人中很常见。
2020年9月,斯万特·帕博(Svante P??bo)等人在 Nature 发表论文指出【2】,感染新冠肺炎后发展为重症的风险是由从尼安德特人那里遗传的大约50kb长度的基因组片段所引起的,这一遗传风险在南亚和欧洲人群中最高,而在东亚和非洲则几乎没有。

2020年9月,斯万特·帕博等人在 Molecular Biology and Evolution 期刊发表论文指出【3】,欧洲三分之一的女性从尼安德特人那里遗传了孕酮受体基因——一种与生育能力提高、妊娠早期出血减少和流产减少相关的基因变异。

2020年7月,斯万特·帕博等人在 Current Biology 期刊发表论文指出【4】,现代人类对疼痛的敏感性遗传自尼安德特人,这也解释了欧美人群为何对疼痛更加敏感。

是什么让我们成为独一无二的人类?
现代人类(智人)的特点是其创造复杂文化、先进创新和具象艺术的独特能力,以及穿越开阔水域并向世界各地迁移的能力。
尼安德特人也过着群居生活,拥有巨大的大脑,他们也会使用工具,但在数十万年的时间里,他们对这些工具的发展却很少。
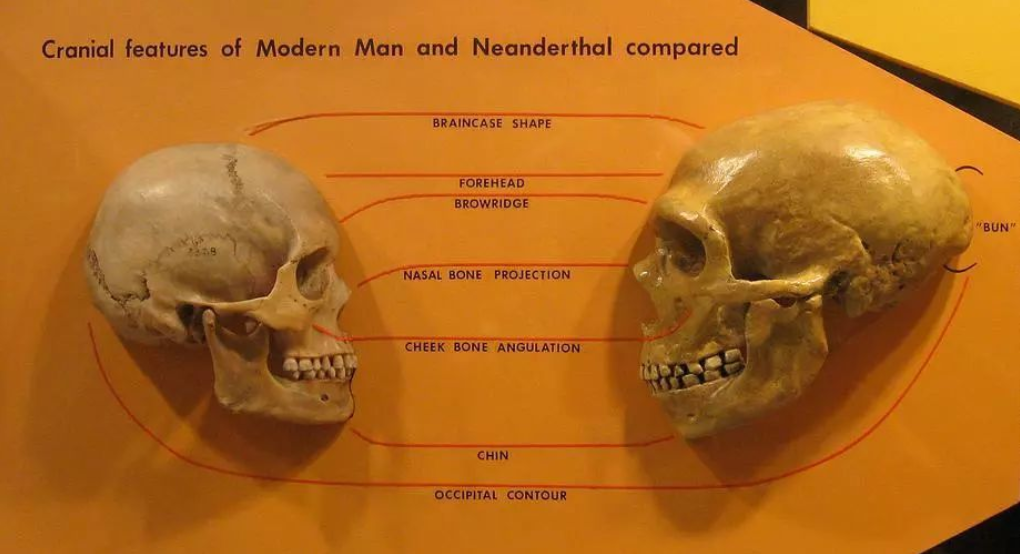
现代人类头骨(左)与尼安德特人头骨(右)
现代人类(智人)和已经灭绝的这些近亲之间的基因差异一直是未知的,直到斯万特·帕博(Svante P??bo)做出这些开创性的工作,让我们得以研究并探索这些已灭绝的古人类与现代人类在基因组层面的差异。
例如,2022年9月9日,Science 上发表的一篇论文指出【5】,一个关键蛋白——TKTL1 上的一个氨基酸的差异,让我们人类比尼安德特人具有了显着优势,增加了大脑神经细胞的产生,这可能是现代人类与已灭绝的其他古代人类之间的认知差异的基础。

2021年2月12日,Science 期刊发表的一篇论文发现【6】,现代人类与尼安德特人和丹尼索瓦人这两种已灭绝古人类存在的一个重要差异基因——NOVA1。通过CRISPR-Cas9基因编辑,将古人类的NOVA1基因版本引入人类多能干细胞,并培养成“大脑类器官”,发现古人类“大脑类器官”的神经发育、细胞增殖、突触连接相关基因的剪接发生了明显改变。
结果表明,在人类和尼安德特人“分开”之后, NOVA1 基因在现代人类中形成了稳定的新版本,这很可能对我们人类这个物种的进化产生功能性影响。

目前,大量研究正在探索这些基因组差异带来的影响,最终将帮助我们解释我们为何能成为独一无二的人类。
参考资料:
1.https://www.nobelprize.org/prizes/medicine/2022/advanced-information/
2.https://www.nature.com/articles/s41586-020-2818-3
3.https://doi.org/10.1093/molbev/msaa119
4.https://doi.org/10.1016/j.cub.2020.06.045
5.https://www.science.org/doi/10.1126/science.abl6422
6.https://science.sciencemag.org/content/371/6530/eaax2537
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













