Mol Cell:中山大学徐瑞华/鞠怀强揭示IL-1β促进肿瘤免疫治疗抵抗新机制
2023-05-29 iNature iNature 发表于威斯康星
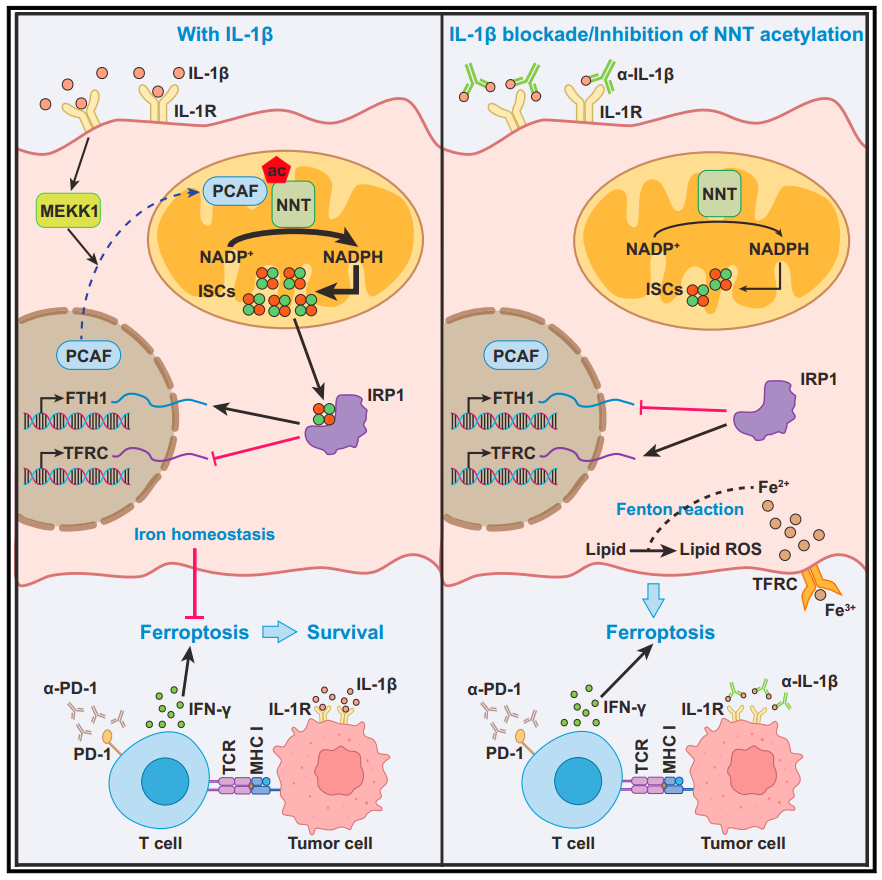
该研究发现,在IL-1β刺激下,癌细胞中的烟酰胺核苷酸转氢酶(NNT)在赖氨酸(K) 1042位点(NNT K1042ac)发生乙酰化,从而诱导p300/ cbp相关因子(PCAF)的线粒体易位。
白细胞介素-1β (IL-1β)是炎症的关键蛋白,有助于肿瘤的进展。然而,IL-1β在癌症中的作用是模糊甚至矛盾的。
2023年5月26日,中山大学徐瑞华及鞠怀强共同通讯在Molecular Cell 在线发表题为“IL-1β-associated NNT acetylation orchestrates iron-sulfur cluster maintenance and cancer immunotherapy resistance”的研究论文,该研究发现,在IL-1β刺激下,癌细胞中的烟酰胺核苷酸转氢酶(NNT)在赖氨酸(K) 1042位点(NNT K1042ac)发生乙酰化,从而诱导p300/ cbp相关因子(PCAF)的线粒体易位。这种乙酰化通过增加NNT对NADP+的结合亲和力来增强NNT的活性,从而促进NADPH的产生,从而维持足够的铁硫簇维持并保护肿瘤细胞免于铁死亡。
停用NNT K1042ac可显著减弱IL-1β促进的肿瘤免疫逃逸,并与PD-1阻断协同作用。此外,NNT K1042ac与IL-1β的表达和人胃癌的预后相关。该研究结果证明了IL-1β促进肿瘤免疫逃避的机制,暗示了通过抑制NNT乙酰化破坏IL-1β与肿瘤细胞之间的联系的治疗潜力。

慢性炎症是癌症的标志许多实体恶性肿瘤似乎是由慢性炎症引起的,长期使用非甾体抗炎药(NSAIDs)已被证明可以降低多种癌症的风险。胃癌(GC)是世界上第五大常见癌症,与慢性炎症密切相关,这在很大程度上归因于幽门螺杆菌感染的流行据报道,在促炎细胞因子中,IL-1β与癌症的相关性最大,尤其是胃癌。仅IL-1β表达升高就足以诱导胃发育不良/胃癌。虽然促进肿瘤进展是其主要功能,但IL-1β也通过激活3型先天淋巴样细胞(ILC3s)或触发CD8+抗肿瘤免疫反应显示出抗肿瘤潜力。因此,阐明IL-1β的确切机制是一个尚未满足的需求。迄今为止,大多数关于IL-1β的研究都集中在其对免疫细胞或炎症细胞的作用上;然而,IL-1β活性对肿瘤细胞的影响经常被忽视,并且在很大程度上仍然未知。
蛋白质的乙酰化最初被确定为组蛋白翻译后的主要修饰。随后的蛋白质组学研究表明,这种修饰是普遍存在的,特别是在代谢蛋白和线粒体蛋白中,因为63%的线粒体定位蛋白含有赖氨酸乙酰化位点。此外,许多参与中间代谢的乙酰化酶已被证明通过影响酶的活性和/或酶的稳定性来调节代谢酶,这对于响应营养可利用性和微环境因素的代谢重新布线至关重要。值得注意的是,越来越多的数据表明,代谢酶的乙酰化直接影响癌细胞的代谢,这是肿瘤发生的一个标志。然而,参与调节赖氨酸乙酰化介导的代谢重编程和肿瘤进展的促炎细胞因子在很大程度上是未知的。
机理模式图(图源自Molecular Cell )
烟酰胺核苷酸转氢酶(NNT)是一种位于线粒体基质上的酶,锚定在线粒体内膜(IMM)上,在那里它利用跨膜的质子梯度,通过催化氢化物从NADH到NADP+的转移,产生高达50%的线粒体NADPH池。人类NNT纯合零突变可引起家族性糖皮质激素缺乏综合征。此外,在移植的小鼠和人类肿瘤(包括非小细胞肺癌、肾上腺皮质癌、黑色素瘤和肝癌移植)中,NNT已被证明通过维持氧化还原平衡或Fe-S蛋白功能来促进肿瘤进展。作者最近的研究也强调了NNT在胃癌氧化还原调控和肿瘤进展中的关键作用。尽管NNT失调是肿瘤进展的危险因素,并与不良预后相关,但NNT是否在翻译后受微环境因素调控以支持肿瘤进展尚不清楚。
总之,研究人员发现IL-1β通过一种以前未揭示的机制促进肿瘤免疫逃避。IL-1β通过K1042乙酰化增加NNT活性,产生NADPH并维持足够的ISCs。通过IL-1β中和阻断NNT乙酰化与抗PD-1治疗协同作用,显著诱导肿瘤细胞铁死亡。总之,这些数据强调了通过阻断NNT K1042乙酰化破坏IL-1β和肿瘤细胞之间连接的治疗潜力。
原文链接:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(23)00335-0
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











学习了,谢谢分享
36