Nature子刊:范骁辉/陈华钧/高月团队开发空间解卷积算法Bulk2Space,将Bulk转录组重构至单细胞空间分辨率
2022-11-24 测序中国 测序中国 发表于上海
与RCTD、SpatialDWLS、stereoscope和SPOTlight等传统空间解卷积算法不同,Bulk2Space可以基于批量RNA-seq生成空间分辨的单细胞转录组学数据。
近年来,空间分辨转录组学的进步使得在空间水平上了解组织的细胞组成、分子结构和功能成为可能,但目前的单细胞测序及空间转录组技术不仅耗时且成本极为昂贵,严重限制了其推广应用。混样测序(Bulk RNA-seq)已广泛应用于转录组分析,但BulkRNA-seq只能检测细胞混合物中的基因表达,不能揭示单细胞的转录异质性和空间模式。
许多大型测序项目例如ENCODE、TCGA、ICGC等为生物学和临床相关研究累积了海量数据资源。计算机方法具有巨大潜力,可以在单细胞分辨率下利用RNA-seq数据预测空间异质性,但CPM、CIBERSORT和MuSiC等方法目前只能从RNA-seq数据中推断出细胞类型的比例,无法进一步生成单细胞数据。因此,如何充分利用原有数据资源,从Bulk数据中得到单细胞分辨的空间基因表达谱,是生物学研究的一项技术挑战。
近日,浙江大学药学院、长三角智慧绿洲创新中心范骁辉教授团队联合计算机科学与技术学院陈华钧教授团队和军事医学科学院高月教授团队在Nature Communications上发表了题为“De novo analysis of bulk RNA-seq data at spatially resolved single-cell resolution”的研究文章。研究团队介绍了一种基于β-VAE等深度学习框架的空间解卷积算法——Bulk2Space,首次实现将Bulk转录组重构至单细胞空间分辨率。该方法利用现有的高质量scRNA-seq数据和空间转录组学数据作为参考,基于Bulk转录组生成了空间分辨率的单细胞表达谱,揭示了不同肿瘤区域中B淋巴细胞的基因表达差异,以及组织在炎癌转化过程中的空间转录异质性。
主要研究内容
Bulk2Space算法分为解卷积和空间映射两个步骤。其利用β-VAE在聚类空间内将异质转录组解卷积为单细胞转录组数据,然后使用空间转录组参考将生成的单个细胞分配到最佳空间位置。对于空间映射,研究人员将两种最常用的空间分辨转录组学方法作为空间参考,即基于空间条形码的RNA-seq方法和基于图像的靶向方法(图1)。
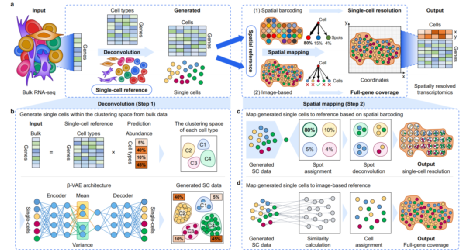
图1:Bulk2Space的工作流程。来源:Nature Communications
为了证明Bulk2-Space解卷积步骤的稳健性,研究人员利用β-VAE对来自人类血液、大脑、肾脏、肝脏和肺以及小鼠脑、肾脏、肺、胰腺和睾丸的10个不同高质量单细胞数据集的30个配对模拟,以及人类胰腺的8个单细胞RNA序列数据中的12个非配对模拟进行了基准测试。结果表明,与GAN、CGAN和bMIND解卷积方法相比,Bulk2Space的表现更优秀。虽然CGAN在单细胞生成中与Bulk2Space性能相当,但其计算速度明显低于Bulk2Space。随后,研究人员对Bulk2Space解卷积步骤进行了100次重复,结果表明,Bulk2Space在100次重复中保持高度稳健(图2)。
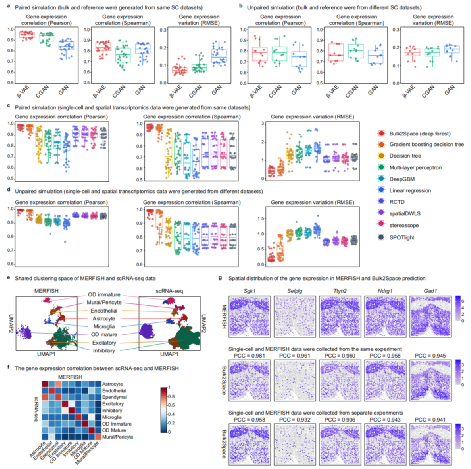
图2:Bulk2Space的基准测试。来源:Nature Communications
为了进一步验证Bulk2Space的性能,研究人员分别使用来自同一黑色素瘤组织的两个连续切片和来自不同PDAC组织的另外两个离散切片,执行Bulk2-Space空间解卷积相同的程序。结果显示,生成的数据与参考之间的细胞类型特异性标记基因的表达高度相关,生成单个细胞的空间分布模式与不同区域的组织学注释一致。表明Bulk2Space可以从bulkRNA-seq或scRNA-seq预测空间分辨的单细胞转录组学数据,因此可以发现相同细胞类型的空间异质性,这是其他空间解卷积算法难以实现的。
随后,研究人员进一步验证了Bulk2Space算法的性能。利用inDrop-seq测序scRNA-seq数据作为PA组织和PDAC数据的单细胞参考,基于空间条形码的ST数据作为空间参考,结果表明,Bulk2Sapce生成的单细胞信息与参考数据之间细胞类型特异性标记基因的表达高度相关(图3)。
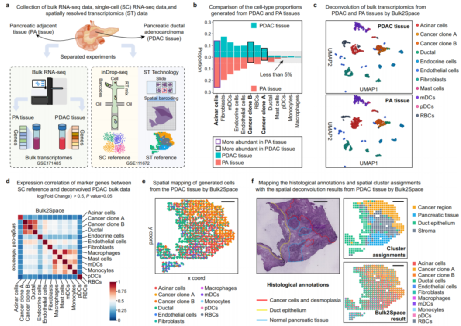
图3:基于Bulk2Space的PDAC空间解析;来源:Nature Communications
Bulk2Space除了连接病理组织中的组织形态学和转录组学外,另一个应用是利用空间模式重构组织结构。研究人员通过多重RNA-seq方法(Spatial-seq)从小鼠大脑的冠状和矢状切片中分离和测序了13个主要大脑区域,获得了大量转录组学数据。将小鼠大脑的矢状切片分成两部分,使用10XVisium进行测序,获得了小鼠皮质等区域的空间转录组学数据。
大量的数据首先被解卷积成单细胞RNA-seq数据,随后将生成的单细胞通过Bulk2Space映射到空间位置,证明了Bulk2Space具有重建组织空间组织的能力。此外,Bulk2Space在单细胞分辨率下预测的细胞类型特异性标记基因的空间表达模式与相应细胞类型的比例分布一致(图4)。
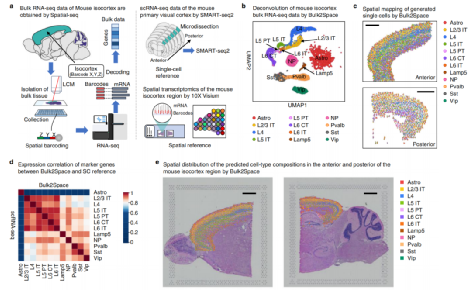
图4:Bulk2Space重建小鼠皮质等区域的层次结构。来源:Nature Communications
肿瘤的发展与慢性感染、饮食因素、肥胖、环境污染、吸烟和自身免疫有关。为了探索Bulk2Space是否可以识别在炎症诱导的癌症中协调肿瘤促进作用的细胞和分子途径,研究人员对前列腺癌的大量转录组数据进行解卷积,并将Bulk2Space生成的单个细胞映射到相应的空间参考,包括正常腺体、炎症组织和肿瘤部位。正常、炎症和癌组织之间的细胞分布比较表明,在正常腺体中,癌症相关成纤维细胞(CAF)是最丰富的,但在炎症和癌症组织中,CAF的比例显著降低。在炎症诱导的前列腺癌发展过程中,CAFs早期在正常腺体中积累,导致炎症因子高表达,促进局部炎症的发生,从而导致组织癌化,Bulk2Space结果与这一现象一致。
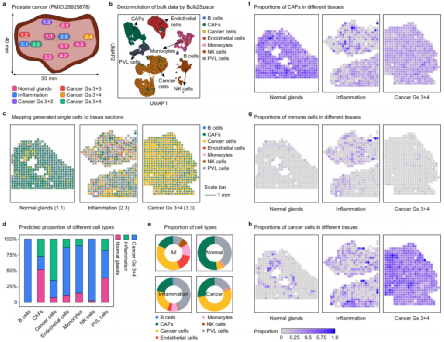
图5:Bulk2Space揭示炎症诱导前列腺癌不同阶段的空间基因表达动态。来源:Nature Communications
结 语
与RCTD、SpatialDWLS、stereoscope和SPOTlight等传统空间解卷积算法不同,Bulk2Space可以基于批量RNA-seq生成空间分辨的单细胞转录组学数据。此外,Bulk2Space能够从空间分辨的转录组学数据中分析单个细胞的空间异质性,无需单细胞分辨率。Bulk2Space具有很好的生物学和临床应用前景,包括揭示细胞的空间特异性变异,发现新基因的空间表达模式,实现更精细的细胞聚类,预测分子疾病进展的潜在机制等。
Bulk2Space在GitHub(https://github.com/ZJUFanLab/bulk2space)上开放访问。
参考资料:
Liao, J., Qian, J., Fang, Y. et al. De novo analysis of bulk RNA-seq data at spatially resolved single-cell resolution. Nat Commun 13, 6498 (2022). https://doi.org/10.1038/s41467-022-34271-z
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言