机械通气重症患者肠内喂养不耐受的发生率、风险 因素与临床结局:一项多中心、多年数据库的分析
2023-02-08 网络 网络 发表于上海
该项研究是迄今样本量最大、涉及全球775个ICU、15,000例接受机械通气的 ICU 患者营养治疗临床研究,反映了随时间推移临床营养治疗实践的质量改变。


北京清华长庚医院 谈莉/许媛 译
遵义医科大学附属医院 付豹 审
上海交通大学医学院附属瑞金医院 陈德昌 述评
北京清华长庚医院 许媛 述评
目的:确定重症患者肠内喂养不耐受的发生率,识别与肠道喂养不耐受相关的因素,并评估肠内 营养喂养不耐受与主要营养指标及与临床结局之间的关系。
研究设计:对2007年 ~2014年前瞻性收集的国际营养调查数据库数据进行分析。
数据:来自全球785个ICU营养调查数据。
患者:机械通气并在ICU停留≥72小时,且入ICU后12天内接受肠内营养的成年患者。
干预措施:无。
指标及主要结果:将肠内喂养不耐受定义为由于以下原因之一而中断喂养:胃残留量高、腹围增大、腹胀、主观不适、呕吐或腹泻。15,918 例患者纳入当前数据分析,其中,4,036例(24%)至少有1次肠内喂养不耐受。肠内喂养不耐受率从第 1 天的 1% 上升到第 4 天和第5天的 6%, 此后逐日下降。在控制了地区及患者协变量后,入院诊断为烧伤 [ 比值比(odds ratio,OR)1.46; 95% CI,1.07~1.99]、胃肠道疾病(OR 1.45;95% CI,1.27~1.66)、脓毒症(OR 1.34; 95% CI,1.17~1.54)患者相比呼吸相关疾病诊断入院的患者,出现肠内喂养不耐受可能性更大。 在控制了包括疾病严重程度在内的重要协变量后,与无肠内喂养不耐受的患者相比,肠内喂养不耐受患者的肠内营养摄入量减少了约 10%,且无机械通气天数更少,收住 ICU 直至存活出院的时间更长(所有 P < 0.0001)。一旦发生肠内喂养不耐受,每日死亡危险率增加1.5倍(1.4~1.6;P < 0.0001)。
结论:重症患者肠内营养期间常合并喂养不耐受。烧伤和胃肠道疾病患者出现肠内喂养不耐受的 风险最高。肠内喂养不耐受的识别、预防和优化管理可改善 “高危”人群的营养供给和临床结局。
关键词:临床预后;重症患者;肠内喂养不耐受;肠内营养;营养支持;调查
重症营养指南推荐机械通气患者给予肠内营养治疗[1,2]。但肠内喂养不耐受(enteral
feeding intolerance,EFI)在重症疾病的急性期很常见,并由此导致营养供应不足 [3,4]。EFI 的定义不明确,通常包括胃残余量高(gastric residual volume,GRV),表示胃排空延迟,其他胃肠道(gastrointestinal,GI)体征与症状还有腹围增加、腹胀或不适感、呕吐和腹泻 [5,6]。最近的研究对 GRV 测量的实用性提出了挑战,过度关注 GRV的监测可能导致医源性营养不良 [7-9]。此外,最近关于高GRV时使用促动药的临床研究未能证明其益处 [10,11]。这些发现使我们重新审视高GRV作为胃排空延迟标志的有效性和实用性。
国际营养调查(International Nutrition Survey,INS)是一项质量改进项目,旨在通过收集有关营养过程与治疗的结果来帮助参研单位改进营养治疗实践。使用整合多年国际营养调查(2007年~2014年)的数据集,纳入分析的样本量比之前更大[3],我们的主要目标:1)重新评估 EFI 的发生率,2)确定发生 EFI 的相关因素,3)评估不耐受对重症患者关键营养与临床结局的影响。我们假设 EFI 会经常发生,大部分发生在危重疾病的早期,并且与较低的营养摄入和较差的临床结局相关。
材料与方法
研究设计
我们对历年(2017年~2014年)的前瞻性国际营养实践调查(INS)收集的数据进行回顾性分析。INS 审核的方法早已发布[12],此次未获知情同意,但研究得到昆士兰研究伦理委员会批准。
数据建立
组合后的(2017年 ~2014年)INS 数据库包含来自41个国家 785 个ICU的 21,100例患者的数据。
参与者
纳入INS的数据:ICU 成年重症患者(年龄≥ 18岁),接受机械通气≥ 48 小时,收住ICU至少72小时。本次分析排除了入ICU 前开始肠内营养(enteral nutrition,EN)或肠外营养(parenteral nutrition,PN)、在入住ICU前12天内未接受EN、在EN 开始之前接受了促动力药,或记录的基线体重<30kg或 >400kg的患者。
变量与数据源/指标
在本项观察性研究中,未干扰当地的营养治疗实践。根据当地标准和方案对患者进行评估与营养供给。从医院记录中提取了有关患者人口统计与临床特征、营养状况及临床结局的
数据。记录入住ICU前12天每天的营养处方、使用的营养产品和接受量。根据出 ICU、死亡或过渡到完全纯口服喂养前的ICU 第 2~12天(入ICU第1日视为不足一整日)计算EN接受的基线处方比例(此处称为 EN 充分性)。在INS 数据库中,EFI由当地ICU根据每日数据收集表中记录的因 GI 并发症(即高 GRV、腹围增加或腹胀、呕吐、腹泻或主观腹部不适)而中断肠内营养进行定义。这些特定的 GI 并发症并未由本研究团队定义,而是用参研单位的定义,我们记录了ICU特定的GRV阈值以调整 EN 喂养量。进一步将 EFI细分为仅在一天中发生(单日)或在两日还是多日内发生。临床结局包括医院 死亡率、ICU 住院天数(length of stay,LOS)、医院 LOS、前28天内无呼吸机使用天数(ventilator-free day,VFD)及至存活出院时间。
统计方法
在估计以下数据时,我们使用广义估计方程(generalized estimating equation,GEE)来考虑由ICU引起的聚类:EFI 率(图1)(电子表2,补充内容1,http://links.lww.com/ CCM/F932),EFI组间比较患者特征的P值(表1)、任何EFI(表2)或第二次EFI(电子表3,补充内容1,http:// links.lww.com/CCM/F932)的预测因子的比值比,以及EFI组间EN充分性、无呼吸机天数和死亡率的差异(表3)(电子表4,补充内容1,http://links.lww.com/CCM/F932)。对于二分类结局,GEE使用具有二项式分布的logit链接,而连续变量则采用具有正态分布的恒等链接。当估计P值以比较EFI组间名义患者的特征时,我们使用 Rao-Scott 调整卡方方法来解释ICU群集(表1)。用Cox比例风险回 归模型和稳健标准误来解释在比较ICU LOS和存活出院时间时的ICU异质性(表3)(电子表 4,补充内容 1,http:// links.lww.com/CCM/F932)。通过线性混合效应模型使用限 制的最大可能性对 ICU 和患者进行随机效应,以估算调整后的EFI组间EN充足性的每日差异(电子图2,补充内容1, http://links.lww.com/CCM/F932)。
使用 Kaplan-Meier 曲线和平滑的未经调整的每日危 险率曲线描述入ICU60天内的住院死亡率(电子图3,补充内容1,http://links.lww.com/CCM/F932)。我们用Cox比例风险回归模型(稳健标准误),将EFI的发生作为时间相关的协变量,以估计EFI发生前、后的死亡率的危险比(hazard ratio,HR)(电子表7,补充内容 1, http://links.lww.com/CCM/F932)。我们注意到与时间相关的HR在一段时间内不是恒定的,因此也对分段HR做了建模。
除比较EFI发生率与患者特征外,所有EFI的组间比较与建模之间均受以下协变量控制:年份、地区、性别、急性生理和慢性健康评估(Acute Physiology and Chronic Health Evaluation,APACHE)II 评分、主要诊断的入院类型、体重指数以及热卡与蛋白质处方量。对EFI组平均EN充分性的比较分析还控制了用于计算平均值的ICU天数进行校正。我们仅对 GRV > 250 mL 的地区进行了亚组分析,前提是这一标准更符合当前情况。使用SAS V 9.4(SAS Institute,Cary,NC)进行分析。
结果
全部785个ICU中有580个ICU(74%)使用不同的GRV阈值来调整 EN,其中定义EFI 的GRV阈值平均为259 mL(范围50~501mL),且GRV阈值随年代增长及地区不同而变(电子表1,补充内容 1,http://links.lww. com/CCM/F932)。
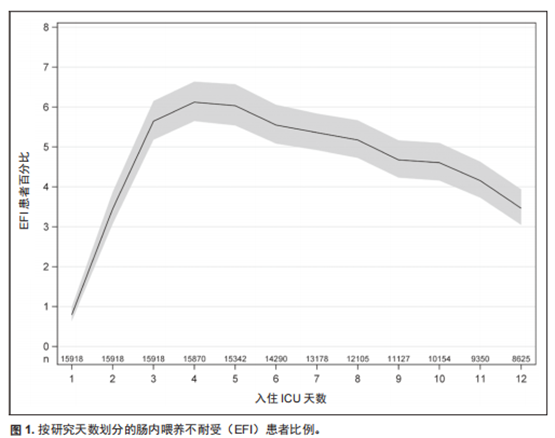
我们从775个ICU中筛选出满足标准的 15,918 例患者纳入分析(电子图1,补充内容 1,http://links.lww.com/CCM/F932),EFI的总发生率为 24%(95% CI,23%~26%)。 电子表2(补充内容 1,http://links.lww.com/CCM/F932)提供了按地区与时间(年份)发生的任一EFI、单日或多日发生EFI的情况、以及仅因GRV标准诊断的EFI与仅由症状和体征诊断的EFI发生率(即,不归因于 GRV)。EFI总体发生率随时间推移而降低,从2007年 32% 降至 2014 年的 20%(电子表 2,补充内容 1, http://links.lww.com/CCM/F932)。图1描述了按ICU天数报告的合并 EFI 患者的比率,发生率从第1天的略低于1%上升到第 4天与第5天的峰值 6%,此后逐日下降。与因症状而出现EFI的患者相比,第一次以 GRV 诊断的EFI患者的风险是二次出现EFI的危险的1.4倍(95% CI, 1.2~1.61;P = 0.0003)。
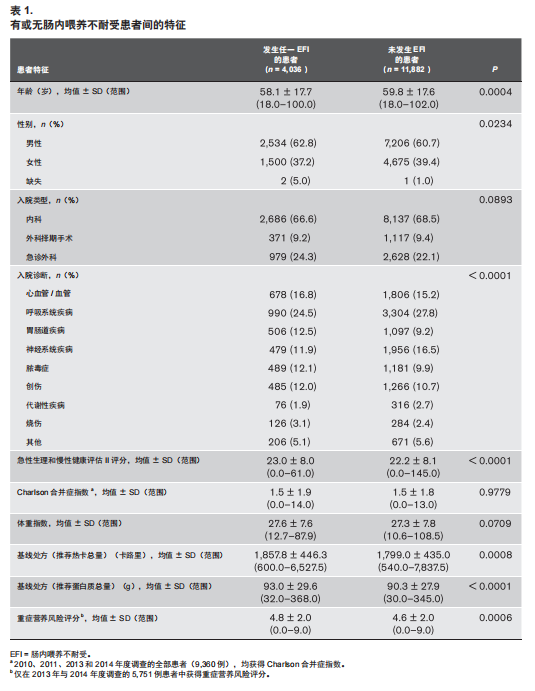
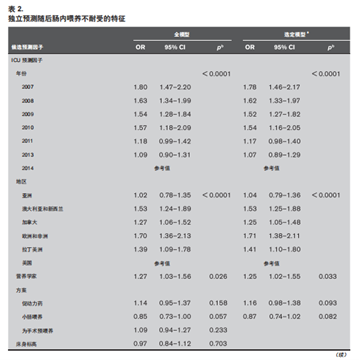
表1显示了在ICU前12天内发生EFI的4,036例患者的特征,以及 11,882 例未发生 EFI 患者的特征。与呼吸疾病相关的入院诊断的患者相比,烧伤、心血管疾病、胃肠道疾病和脓毒症患者发生EFI的可能性更高,而代谢与神经系统疾病的患者发EFI的可能性较低(表 2)。在至少1天的EFI患者中, 没有基线患者特征可预测额外的EFI天数(电子表 3,补充内容1,http://links.lww.com/CCM/F932)。
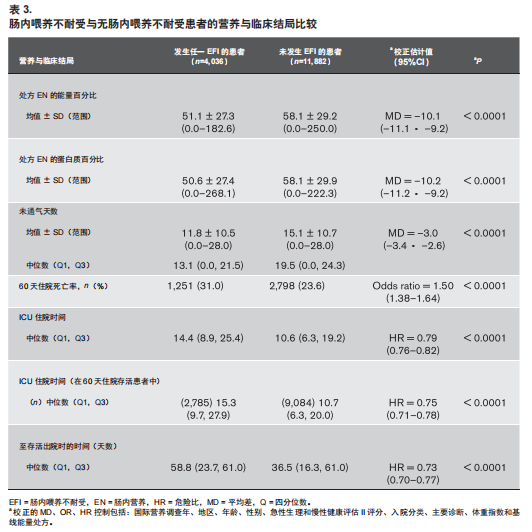
与无EFI的患者相比,在ICU前12天内任何时间发生EFI的患者其EN充分性明显降低(图2和表3)。控制协变量后亚组分析并无差异,第5日EFI患者的热卡(卡路里) 较未发生EFI的患者减少11%~15%(电子图 2,补充内容 1, http://links.lww.com/CCM/F932),对GRV大于250地区的亚组分析并未见差异(电子表 4,补充内容 1,http://links.lww. com/CCM/F932)。
EFI患者粗60天住院医院粗死亡率为31%,而无EFI的患者为24%[ 校正比值比(odds ratio,OR)= 1.5(95% CI,1.4~1.6);P < 0.0001)](表3)。EFI与死亡率间的相关 性仅发生在ICU的第一周后(电子图3,补充内容 1,http:// links.lww.com/CCM/F932)。任何发生过EFI的患者,28天内无机械通气时间(VFD)更少,ICU LOS更长(仅总体患者和幸存者),存活出院时间更长(表3)(所有P< 0.0001)。与单日 EFI 的患者相比,多日EFI患者的EN充足率降低约5%,VFD减少,死亡率更高,ICU LOS 更长(总体和幸存者中),存活出院时间更长(电子表5,补充内容 1,http:// links.lww.com/CCM/F932)(所有P< 0.001,除外死亡率P=0.016)。所有 GRV >250mL为标准的 ICU 亚组分析中结果无差异,尽管某些分析由于样本量较小而失去了统 计学意义( 电子表6,补充内容 1,http://links.lww.com/ CCM/F932)。将EFI建模为时间依赖性协变量,EFI 发 生前后相比,死亡率的平均校正后 HR 为 1.5(95% CI, 1.4~1.6;P < 0.0001)。该 HR 的范围从前 10 天的 1.4 到30 天 ~60 天 的 1.8(电子表7,补充内容 1,http://links. lww.com/CCM/F932)。


讨论
我们使用全球775个ICU中超过15,000例患者的营养数据, 观察到EFI较常见,它的ICU发生率随时间和地区的不同而有别,第4~5天达到高峰,并以单日或多日的形式出现。随着时间的推移,EFI的发生率似乎在下降,并且与定义EFI的GRV阈值增加同步,EFI对营养与临床结局有显著的负面影响,多日发生EFI较单日发生EFI者预后更差。如果我们仅仅将分析集中在使用250mL或更高GRV阈值的研究中心,这一发现没有改变。此外,我们研究发现,高APACHE II评分、烧伤、胃肠道疾病与脓毒症患者发生 EFI 可能性更大。与其他定义诊断 的 EFI 患者相比,应用高 GRV 为标准判断 EFI 的患者重复发生EFI可能性更大。这些发现有助于全球范围内提高对 EFI相关疾病负担的认识。
明确与EFI相关的不良后果是本研究最重要的发现之一。 发生EFI的患者营养摄入不足、VFD减少的可能性更大,ICU停留时间与住院时间更长,死亡率更高,多次合并EFI的患者预后更差。这一发现与最近的一项机器学习研究结果一致,该研究分析表明每日GRV 无改善是死亡率的重要预测因子[13]。尚不清楚EFI是严重疾病的附带现象还是获得性肠道 功能障碍的指征,研究报道中显露出来肠道停止工作似乎与EFI存在因果关联。比较脓毒性休克接受机械通气患者早期EN与“无EN”的先导随机对照研究(randomized controlled trial,RCT)发现,“无 EN”组的EFI发生率更高,表明无肠内营养会削弱肠屏障与消化功能,表现为EFI[14]。一项比较 28 例成年外伤患者早期EN与延迟EN的RCT发现,晚期 EN患者肠道通透性与EFI发生增加,且后期发展为多器官功能 衰竭的可能性更大[15]。
探讨与“高营养风险”患者群体预后相关的最佳预防或治疗性营养策略是研究的重中之重[16]。我们假设少数高营养风险的ICU患者,可能会因为EFI导致相关临床不良预后。
本研究显示,EFI患者的营养风险评分高于未发生EFI的患者。 缺乏标准的EFI定义仍然是重症营养领域的一个挑战,为使我们对EFI有进一步的了解,并确定可以随机分配不同治疗策略的人群以评估治疗效果,需要一个标准化、可靠和有效的测量方法则更为理想。如其他研究所述,临床医生和研究人员使用多种评估工具来判断 EFI,其中最常用的是高 GRV[5,6],而无异质性的肺炎群体常规 GRV 监测并未获益[9],所以许多专家认为评估 GRV 并无价值[17]。我们研究表明,当使用 GRV 监测时,与单日 EFI 相比,它更可能与多日 EFI 相关。与其他胃肠道症状相反,高 GRV 与胃排空延迟有关[18]。因此,我们质疑仅靠临床检查与症状评估是否可以识别出可能获益于潜在治疗方法(如促动力药使用)的恰当患病人群。在最近的研究中,在单日EFI发作后随机使用促动力药并未发现有差异,而一项需要连续两日EFI发作的试验显示了一定的获益[10,11]。如果将 GRV用于EFI评价,则500 mL阈值与较低阈值一样安全有效[19]。
本研究的特点在于,利用最大的、前瞻收集的用数据库 对EFI发生进行了真实评估,从而增强了结果的有效性和普适性。如此大的样本量使我们得以对EFI及其临床影响进行
精确的评估。研究局限性包括残余量混杂、因研究单位仅在EN中断的情况下才记录 EFI,故存在EFI漏报的可能。某些情况下,医生因EFI可能会降低输注速度或加用促动力药,
而不会停止EN 输注。如果 EFI的定义包含这些临床处理, 其发生率可能高达36%[4]。此外,尽管我们观察到这个跨国的大型数据库随时间推移产生重要趋势的变化,但我们不能将这些变化的原因或EFI发生率降低归因于GRV阈值的提高。其他未描述的临床处理改变,如降低镇静剂/镇痛剂使用,也可能解释了这些结果。我们也无法确切解释为什么在EFI之后给予的热卡与蛋白量会发生差异,因为这个数据库既不包含对于EFI的研究中心特定的喂养方案,也不包含患者特定的速度调整方案。
总之,我们的研究发现EFI在危重症早期是较普遍的现象,并且与不良临床结局相关。重要的EFI发生超过2天或更长者(与仅1天相比)与最差的临床结局有关。假设EFI可以预防及治疗,但是缺乏标准定义阻碍了改善这些患者临床预后的尝试。采用较高的GRV阈值进行规律性、重复性的测量,以保证患者获益于更好的EFI干预管理。
致谢
We would like to acknowledge all the ICUs that have participated in the past International Nutrition Survey that have enabled this data analyses.
1 Department of Critical Care Medicine, Kingston Health Science Centre, Kingston, ON, Canada.
2 Clinical Evaluation Research Unit, Kingston Health Science Centre, Kingston, ON, Canada.
3 Department of Public Health Sciences, Queen's University,Kingston, ON, Canada.
4 Department of Intensive Care Medicine, Uniklinik Aachen,RWTH Aachen University, Aachen, Germany.
5 Department of Medicine, Division of Pulmonary&Critical Care Medicine, Medical College of Wisconsin, Milwaukee, WI. 6 Department of Surgery, Division of Trauma, University of Miami,Miami,FL.
7 GI Therapeutic Area Unit, Takeda Pharmaceuticals, Cambridge,MA.
Supplemental digital content is available for this article. Direct URL citations appear in the printed text and are provided in the HTML and PDF versions of this article on the journal's website (http://journals.Iww.com/ccmjournal).
Dr. Heyland received funding from Takeda Pharmaceuticals (con-sulting). Drs. Dukes, Chen, and Almansa disclosed that they are employees of Takeda Pharmaceuticals, and Dr. Heyland functions as a paid consultant for Takeda. Dr. Day's institution received funding from Clinical Evaluation Research Unit, and he disclosed government work. The remaining authors have disclosed that they do not have any potential conflicts of interest.
For information regarding this article,E-mail:dkh2@queensu.ca
参考文献
1. Taylor BE,McClave SA,Martindale RG,et al:Guidelines for the
provision and assessment of nutrition support therapy in the adult criticallyill patient. Crit Care Med 2016; 44:390-438 2. Heyland DK, Dhaliwal R, Drover JW, et al; Canadian Critical Care Clinical Practice Guidelines Committee: Canadian clin-ical practice guidelines for nutrition support in mechanically ventilated, critically ill adult patients. JPEN J Parenter Enteral Nutr2003;27:355-373
3. Gungabissoon U, Hacquoil K, Bains C, et al: Prevalence, risk
factors,clinical consequences,and treatment of enteral feed intolerance during critical illness. JPEN J Parenter Enteral Nutr 2015;39:441-448
4. Wang K, Mcllroy K, Plank LD, et al: Prevalence, outcomes, and management of enteral tube feeding intolerance: A retrospec-tive cohort study in a Tertiary Center. JPEN J Parenter Enteral Nutr2017;41:959-967
5. Blaser AR, Starkopf J, Kirsimägi U, et al∶ How to define feeding intolerance?. Acta Anaesthesiol Scand 2014; 58:914-922
6. Reintam BlaserA,Malbrain ML,StarkopfJ,etal:Gastrointestinal function in intensive care patients: Terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems. Intensive Care Med 2012;38:384-394
7. Mentec H, Dupont H, Bocchetti M, et al: Upper digestive in-tolerance during enteral nutrition in critically ill patients:Frequency, risk factors, and complications. Crit Care Med 2001;29:1955-1961
8. McClave SA, Lukan JK, Stefater JA, et al: Poor validity of re-sidual volumes as a marker for risk of aspiration in critically ill patients. Coit Care Med 2005; 33:324-330
9. Reignier J, Mercier E,Le Gouge A, et al; Clinical Research in Intensive Care and Sepsis(CRICS)Group: Effect of not moni-toring residual gastric volume on risk of ventilator-associated pneumonia in adults receiving mechanical ventilation and early enteral feeding: A randomized controlled trial. JAMA 2013;309:249-256
10. Deane AM, Lamontagne F, Dukes GE, et al: Nutrition ad-equacy therapeutic enhancement in the critically ill: A ran-domized double-blind, placebo-controlled trial of the motilin receptor agonist camicinal (GSK962040): The NUTRIATE Study. JPEN J Parenter Enteral Nutr2018; 42:949-959 11. Heyland DK, van Zanten ARH, Grau-Carmona T, et al;
Investigators of the PROMOTE LP101-CL-201 Trial: A multi-center, randomized, double-blind study of ulimorelin and meto-clopramide in the treatment of critically ill patients with enteral feeding intolerance: PROMOTE trial. Intensive Care Med 2019;45:647-656
12. Heyland DK, Cahill N, Day AG: Optimal amount of calories for critically ill patients: Depends on how you slice the cake! Crit Care Med 2011;39:2619-2626
13. Mataraso S, Panchavati S, Almansa C, et al: Machine-learning based prediction and stratification of patients with enteral feeding intolerance and quantification of clinical outcome. Critical Care 2019;23(Suppl 2):P276
14. Patel JJ, Kozeniecki M, Peppard WJ, et al: Phase 3 pilot ran-domized controlled trial comparing early trophic enteral nu-trition with "no enteral nutrition" in mechanically ventilated patients with septic shock. JPEN J Parenter Entera/ Nutr 202044:866-873
15. Kompan L, Kremzar B, Gadziev E, et al: Effects of early en-teral nutrition on intestinal permeability and the development of multiple organ failure after multiple injury. Intensive Care Med 1999; 25:157-161
16. Arabi YM, Casaer MP, Chapman M, et al: The intensive care medicine research agenda in nutrition and metabolism. Intensive Care Med 2017;43:1239-1256
17. McClave SA, Gualdoni J, Nagengast A, et al: Gastrointestinal dysfunction and feeding intolerance in critical illness: Do we need an objective scoring system? Curr Gastroenterol Rep 2020;22:1
18. Chapman MJ, Besanko LK, Burgstad CM, et al: Gastric emp-tying of a liquid nutrient meal in the critically ill: Relationship between scintigraphic and carbon breath test measurement. Gut 2011;60:1336-1343
19. Montejo JC, Minambres E, Bordejé L, et al: Gastric residual volume during enteral nutrition in ICU patients: The REGANE study. Intensive Care Med 2010; 36:1386-1393
专家述评
陈德昌 上海交通大学医学院附属瑞金医院
营养支持是重症患者治疗的重要组成部分,肠内营养(Enteral Nutrition,EN)是危重患者人工营养的首选途径。EN可以保护消化道的结构和功能,限制细菌的易位[1]。( 早期 EN(患者入院24小时内开始)与感染以及并发症的发生率、住院时间和死亡率的降低相关[2]。然而,肠内营养不耐受 (Enteral Feeding Intolerance,EFI) 在危重症患者中很常见,可导致营养不良,带来不良临床预后[3]。
在一项2007年~2014年的多中心大型回顾性研究中,入选了775个ICU的15,918 例患者,研究统计EFI的发生率,分析EFI发生相关的危险因素,评估肠内营养不耐受对患者营养状态的影响以及肠内营养不耐受患者的临床结局情况。发现在入院诊断为烧伤、心血管 / 血管疾病,胃肠道疾病和脓毒症患者更容易发生EFI,但是在代谢性疾病和神经系统疾病患者中的发生率较低。患者在入住ICU前12天内的任何时间发生EFI,都会导致患者更容易营养不良。同时发生EFI的患者机械通气时间较长,60天死亡率较高。但是这项研究存在一些不完善的地方。
首先研究没有分析这些患者肠内营养中碳水化合物、蛋白质、脂肪具体组成,危重患者给予不同种类的肠内营养,死亡率会有所不同[4],本研究中发生EFI患者蛋白质的摄取较少,这可能会影响两组患者死亡率,需要在分析中控制这个混杂因素。其次,研究中没有说明这些肠内营养的给予剂量以及输注速度,也没有说明这些患者是否使用了胃肠动力药物,这些因素都可能影响患者的结局[5-7],这也是我们在临床中需要明确的地方。本研究没有提供患者腹内压数据,腹内压较高的患者肠内营养不耐受发生率明显升高[8],这也是需要控制的混杂因素。研究中没有说明这些患者肠内营养卡路里的治疗目标。
尽管如此早期识别ICU中发生EFI的高危患者,积极预防以及优化肠内营养,可能能够改善这些患者的预后。
参考文献
1. Anastasilakis CD, Ioannidis O, Gkiomisi AI, Botsios D. Artificial nutrition and intestinal mucosal barrier functionality. Digestion. 2013;88(3):193-208.
2. Doig GS, Heighes PT, Simpson F, Sweetman EA, Davies AR. Early enteral nutrition, provided within 24 h of injury or intensive care unit admission, significantly reduces mortality in critically ill patients: a meta-analysis of randomised controlled trials. Intensive care medicine. 2009;35(12):2018-27.
3. McClave SA, Martindale RG, Rice TW, Heyland DK. Feeding the critically ill patient. Critical care medicine. 2014;42(12):2600- 10.
4. Norman K, Pichard C, Lochs H, Pirlich M. Prognostic impact of disease-related malnutrition. Clinical nutrition (Edinburgh, Scotland). 2008;27(1):5-15.
5. Rubinson L, Diette GB, Song X, Brower RG, Krishnan JA. Low caloric intake is associated with nosocomial bloodstream infections in patients in the medical intensive care unit. Critical care medicine. 2004;32(2):350-7.
6. Krishnan JA, Parce PB, Martinez A, Diette GB, Brower RG. Caloric intake in medical ICU patients: consistency of care with guidelines and relationship to clinical outcomes. Chest. 2003;124(1):297-305.
7. Dickerson RN, Boschert KJ, Kudsk KA, Brown RO. Hypocaloric enteral tube feeding in critically ill obese patients. Nutrition (Burbank, Los Angeles County, Calif). 2002;18(3):241-6.
8. Bordejé ML, Montejo JC, Mateu ML, Solera M, Acosta JA, Juan M, et al. Intra-Abdominal Pressure as a Marker of Enteral Nutrition Intolerance in Critically Ill Patients. The PIANE Study. Nutrients. 2019;11(11).
许 媛 北京清华长庚医院
该项研究是迄今样本量最大、涉及全球775个ICU、15,000例接受机械通气的 ICU 患者营养治疗临床研究,反映了随时间推移临床营养治疗实践的质量改变,也会在一定程度上反映国际重症营养指南的临床指导效力。推进危重症早期肠内营养早已达成国际共识并深入人心,但是随着临床深入也使我们更全面地认识到这项治疗的作用效果和可能带来的风险与伤害。严重疾病和打击相关的肠道缺血 / 再灌注损伤对肠组织、功能微生态环境的影响在不同的患者会有很大的差异,也直接影响早期EN的耐受性与安全性。至今临床上对这方面的评估、检测手段依然有限。本研究阐述了EFI发生的时相特点、疾病特点、临床表现与演变特点(发生高峰、持续时间与规律等),相关影响因素,特别是与不良预后密切相关的特点,将提升临床上对EFI的重视与认识,为完善危重患者肠功能评价与早期 EN 管理策略提供了重要的信息,也为进一步探讨对 EFI 的主动评估监测的手段、GRV 界定标准及其可行性等奠定了基础。但研究是基于早年前瞻设计的营养治疗现况调查的数据库进行的回顾性分析, 对完整描述EFI的特征和影响因素的相关信息肯定是不足的,如EFI的描述与判断指标与标准、干预手段、临床管理等等,因此除了发生率及其与临床不良结局的关系外,其他关于早期EN期间的喂养不耐受的早期识别与处理是很有限的。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言