5分钟!FDA紧急使用授权批准雅培COVID-19即时检测!
2020-03-28 MedSci MedSci原创
今天雅培宣布,美国FDA授予了其检测新型冠状病毒(COVID-19)的分子即时检测(point-of-care test, POCT)紧急使用授权(Emergency Use Authori
今天雅培宣布,美国FDA授予了其检测新型冠状病毒(COVID-19)的分子即时检测(point-of-care test, POCT)紧急使用授权(Emergency Use Authorization)。
据称,这一检测设备可在5分钟内给出阳性结果,13分钟内给出阴性结果。
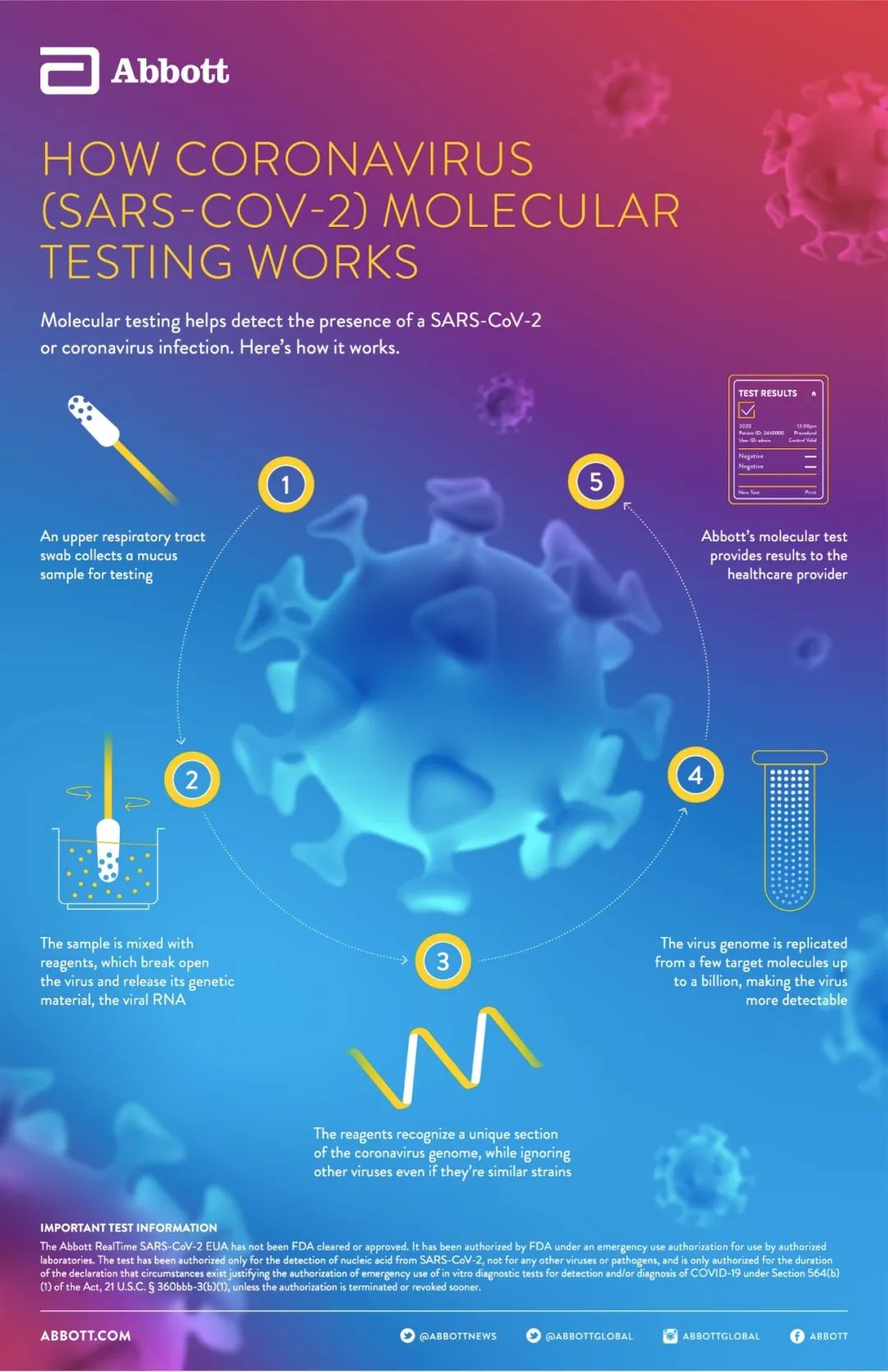
该测试可在雅培ID NOW平台上运行,在医生办公室、紧急护理诊所和医院急诊科等广泛的医疗保健环境中提供快速的结果。ID NOW平台体积小(小型烤面包机尺寸)、重量轻(3kg),并使用分子技术,拥有高度的测试准确性。

公司还指出,从下周开始,雅培将提高生产量,每天为美国医疗保健系统提供5万个 ID NOW COVID-19测试。
截至美东时间27日17时13分,据约翰斯·霍普金斯大学数据,美国COVID-19确诊病例为100,717例,死亡1544例,日新增病例已接近2万人。但截至26日,只有纽约州接受检测的人数超过10万人,有36个州(包括华盛顿特区)的检测人数不足1万人。
其中,纽约州是美国疫情最重的地方。当地时间3月27日,纽约州新冠肺炎确诊病例达到了44635例。纽约州长科莫表示,一天内,纽约州因为新冠肺炎死亡的人数增加了134例。
美国疾病控制和预防中心首席副主任安妮·舒查特在接受《国会山报》独家专访时表示,纽约市目前发生的情况,很可能只是未来美国其他城市的“预演”。目前,美国疾控中心已看到了一些“早期迹象”,表明其他城市的病例数已开始“飙升”,而这几天纽约市疫情的大暴发,只是未来几周内袭击其他城市疫情浪潮中的“第一波”。
目前,美国几家大型实验室每天都要处理数千例新冠肺炎病毒检测工作,他们都表示试剂供应不足。亚利桑那州卫生部主任卡拉·克里斯特尔也提出警告,由于缺少检测试剂盒,该州可能很快将无法继续进行测试。
而此次雅培COVID-19即时检测(point-of-care test)获美国FDA紧急使用授权,可以有效提高识别和隔离感染者的速度,短期内可能会使美国确诊人数激增,但长期将有助于遏制新冠病毒大流行趋势。
▍关于ID NOW分子平台
ID NOW于2014年首次推出,是领先的甲型和乙型流感、甲型链球菌和呼吸道合胞病毒(RSV)检测的分子床旁检测平台。

ID NOW是一种快速、基于仪器的恒温系统,用于定性检测感染性疾病。其独有的恒温核酸扩增技术可在短短几分钟内提供分子结果,让临床医生在患者就诊时做出循证临床决策。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#紧急#
33
#雅培#
38