Nature Biotechnology:诺奖得主Jennifer Doudna开发新型RNA调控工具CRISPR-Csm,效率更高、脱靶性更低
2023-01-26 王聪 “生物世界”公众号 发表于陕西省
该研究开发了基于CRISPR-Csm的新型RNA调控工具,可在人类细胞中高效敲低RNA,效率高达90%-99%,而且具有最低的脱靶效应,还可以作为活细胞RNA成像工具。
在过去20年里,我们可以通过RNA干扰(RNAi)技术实现对真核生物的RNA进行靶向敲低(Knock Down),该技术于2006年获得了诺贝尔生理学或医学奖。但RNAi也存在一些不足之处,例如,RNAi可能导致携带部分序列互补性的靶标的意外切割;RNAi主要在细胞质发挥作用,因此对细胞核RNA的靶向效率低下;RNAi还与某些真核生物系统不相容。因此,开发具有更高特异性和更广泛靶向能力的新型RNA调控工具很有必要。
最近10年里,CRISPR-Cas9基因编辑技术让我们能够高效且精准的靶向编辑DNA,但这种方式带来的DNA双链断裂可能会导致一系列潜在风险,这也限制了其在临床上的应用。而对细胞和生物体的RNA和蛋白质进行修改或调控,能够避免对DNA造成永久性改变,这对基础研究和疾病治疗都非常重要。
CRISPR-Cas系统是细菌和古菌的防御系统,其中Cas作为可编程的DNA或RNA核酸酶发挥作用。与RNAi类似,Cas核酸酶使用crRNA通过碱基配对互补来识别核酸靶标。其中,Cas13能够对真核生物的RNA进行切割,已被开发用于RNA病毒检测工具(例如SHERLOCK系统)。
然而,Cas13不仅会顺式切割靶标RNA,还会反式切割附近的非靶标RNA,这会造成细胞毒性和/或细胞死亡,因此,Cas13可能还不适合作为特异性RNA编辑工具。
2023年1月23日,诺贝尔奖得主 Jennifer Doudna 教授团队在 Nature 子刊 Nature Biotechnology 发表了题为:Precise transcript targeting by CRISPR-Csm complexes 的研究论文,该论文于2022年6月提前在预印本平台bioRxiv上线。
该研究开发了基于CRISPR-Csm的新型RNA调控工具,可在人类细胞中高效敲低RNA,效率高达90%-99%,而且具有最低的脱靶效应,还可以作为活细胞RNA成像工具。这项研究也证实了多亚基CRISPR-Cas系统可作为真核生物RNA靶向工具的可行性和有效性。

VI型CRISPR-Cas13可以在crRNA的引导下切割靶标RNA(顺式切割)。但是,它还可以随机切割附近的其他单链RNA(反式切割),这种非特异性切割活性已被应用于核酸检测,例如张锋团队开发的SHERLOCK系统。但将Cas13应用于疾病治疗时,这种不受控的随机切割活性,就成了致命缺陷。
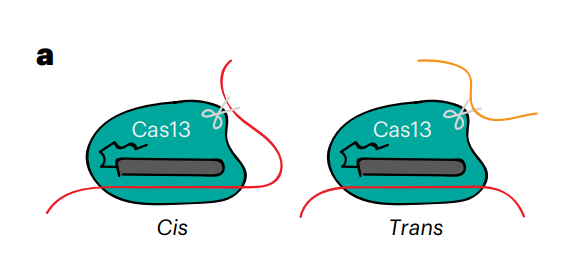
Cas13的顺式切割和反式切割
2022年8月,杨辉团队在 Nature Biotechnology 期刊发表论文,开发了一种高保真Cas13突变体——hfCas13d,既表现出对靶标RNA的高效降解能力,又显着降低了随机切割活性,这为CRISPR-Cas13系统的安全应用打开了新的大门。
详情:专访杨辉:新型Cas13,解决临床应用障碍,让体内RNA编辑和治疗更具竞争力
而 Jennifer Doudna 则把目光放到了其他CRISPR系统上——CRISPR-Csm。CRISPR-Csm是一类III型CRISPR系统,Csm由5个不同亚基组成(Csm1-5),并依赖于额外的Csm6来处理前体crRNA,这种多亚基Cas虽然广泛存在,但相比Cas9这些单亚基Cas,多亚基Cas成分复杂,因此极少被应用。
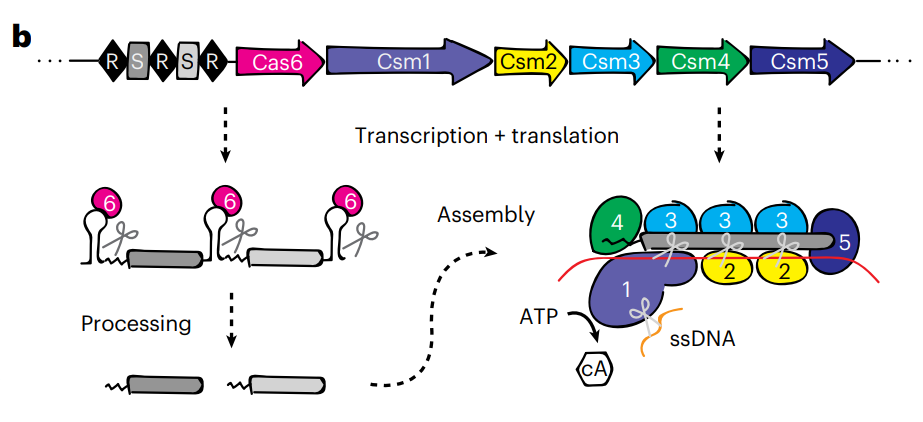
但是,Csm不会像Cas13那样出现反式切割,而且可以进入细胞核,因此能够解决RNAi无法靶向细胞核RNA的问题。因此,Csm具有开发为一种精确且广泛的RNA编辑工具。
在这项研究中,Jennifer Doudna 团队选择了来自嗜热链球菌(Streptococcus thermophilus)的Csm酶,并进行了人类密码子优化、添加细胞核定位信号,将其用于人类细胞的RNA编辑。
研究团队通过单载体递送的CRISPR-Csm系统,对人类细胞中的11个RNA进行编辑(包括3个细胞核非编码RNA和8个细胞质mRNA),结果显示,Csm实现了对全部11个RNA的高效RNA敲低效果(90%-99%)。
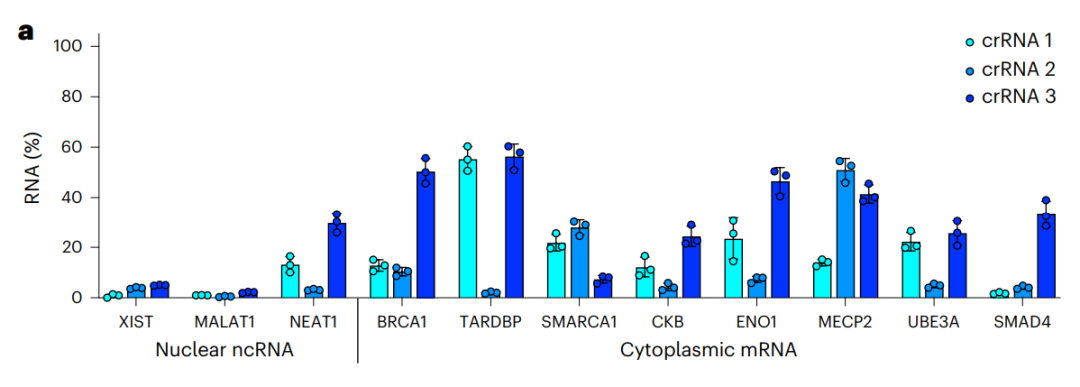
左侧三个为定位于细胞核的非编码RNA,右侧8个为定位于细胞质的mRNA
研究团队还将Csm与Cas13和RNAi(shRNA)这些已有的RNA敲低工具进行了:Cas13能够有效敲低靶标RNA,但也会影响数百个非靶标RNA水平;而shRNA对靶标RNA的敲低效果取决于该RNA定位于细胞核还是细胞质,同时也会影响少量非靶标RNA水平。而Csm介导的RNA敲低,在人类细胞中显示出最小的脱靶效应。
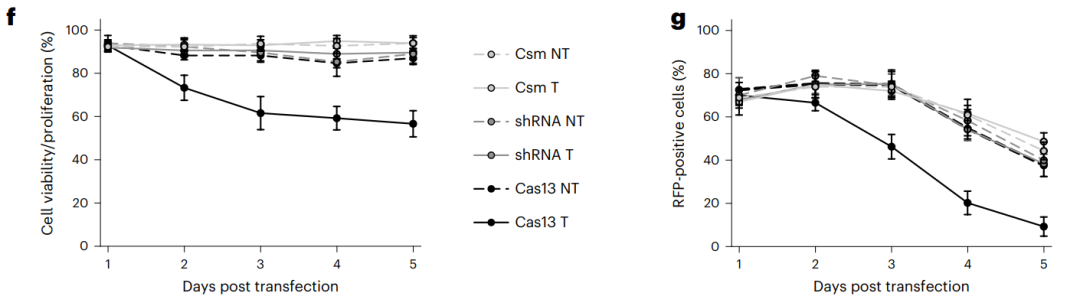
此外,研究团队还发现,Cas13编辑的细胞表现出明显地增殖/活力下降,而Csm或shRNA则几乎不影响细胞增殖/活力。这些结果表明,相比Cas13,Csm介导的RNA敲低对细胞的毒性更小。
最后,研究团队还将催化活性丧失的Csm与绿色荧光蛋白(GFP)融合,实现了对或细胞中特定RNA的成像和追踪。
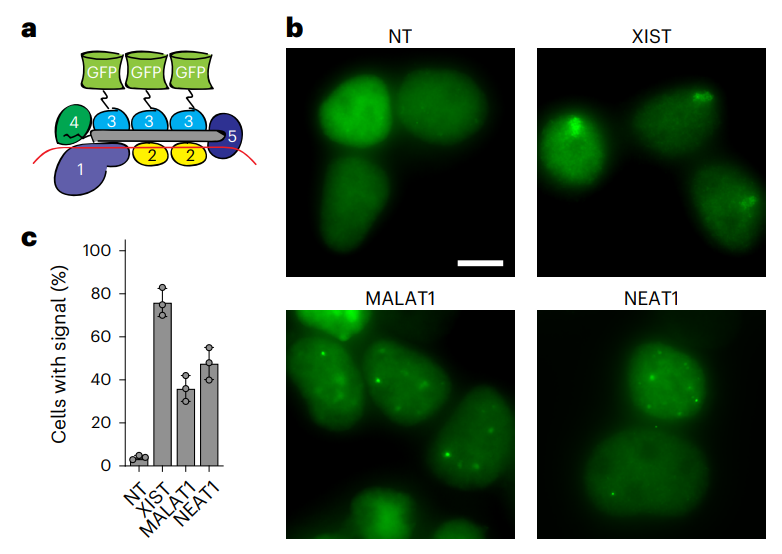
总的来说,这项研究表明,相比Cas13,Csm不具有反式切割活性,更精准和安全;相比RNAi,Csm可以定位于细胞核,可靶向细胞核非编码RNA及Pre-mRNA。因此,Csm可作为一种高效、特异型和通用的真核生物RNA敲低工具。此外,催化活性丧失的Csm还能实现特异性和持久的RNA结合,可用于活细胞RNA成像。
原始出处:
Colognori, D., Trinidad, M. & Doudna, J.A. Precise transcript targeting by CRISPR-Csm complexes. Nat Biotechnol (2023). https://doi.org/10.1038/s41587-022-01649-9.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








Cas13编辑的细胞表现出明显地增殖/活力下降,而Csm或shRNA则几乎不影响细胞增殖/活力。
30