重磅!ADC类药物enfortumab vedotin在中国申报上市
2023-03-13 找药宝典 网络 发表于上海
安斯泰来(Astellas)和Seagen公司宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理 enfortumab vedotin 的生物制品许可申请(BLA),用于治疗先前接受
2023年 3 月 9 日,安斯泰来(Astellas)和Seagen公司宣布,中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理 enfortumab vedotin 的生物制品许可申请(BLA),用于治疗先前接受过 PD-1/L1 抑制剂和铂类化疗的局部晚期或转移性尿路上皮癌(la/mUC)患者。见:Padcev(enfortumab vedotin)在欧盟获准治疗晚期尿路上皮癌

enfortumab vedotin 是国内首款申报上市的靶向Nectin-4 的抗体药物偶联物(ADC),Nectin-4 是一种位于细胞表面并在膀胱癌中高度表达的蛋白质。非临床数据表明其抗癌活性是由于它与表达 Nectin-4 的细胞结合,随后抗肿瘤剂单甲基奥瑞他汀 E (MMAE) 内化并释放到细胞中,导致细胞无法再生(细胞周期停滞)和程序性细胞死亡(细胞凋亡)。
提交的 enfortumab vedotin BLA 是基于 EV-203 研究 (NCT04995419) 的数据,该研究是一项单组、开放标签、多中心的 2 期研究,在既往接受过 PD-1 治疗的中国 la/mUC 患者中进行了 enfortumab vedotin /L1 抑制剂和铂类化疗。结果表明,EV-203 达到了其主要终点,与历史对照相比,单独使用 enfortumab vedotin 治疗患者的独立审查委员会 (IRC) 评审的客观缓解率 (ORR) 显示出统计学意义。该研究的疗效和药代动力学数据与全球数据一致。
除上述消息外,截止到目前,国内获批上市的ADC药物还有T-DM1、维布妥昔单抗、奥加伊妥珠单抗、维迪西妥单抗、戈沙妥珠单抗、DS-8201。详细见:全球获批上市的15款ADC大盘点,中国有6款获批
1、T-DM1(靶向HER2)
2020 年 1 月21日,基于III 期 KATHERINE 研究结果,T-DM1在国内获批上市用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的 HER2 阳性早期乳腺癌患者的辅助治疗,成为国内首款获批的 ADC 药物,开启了中国抗体药物偶联物(ADC)治疗的新时代。
KATHERINE研究共入组了1486例(曲妥珠单抗组和T-DM1各743例)曲妥珠单抗方案新辅助治疗后未达病理完全缓解(pCR)的HER2阳性乳腺癌患者。T-DM1组(3.6 mg/kg IV Q3W,共14周期)和曲妥珠单抗组(6 mg/kg IV Q3W,共14周期),主要研究终点为无侵袭性疾病生存期(iDFS)。2018年SABCS大会上报道了中位随访41个月的初次分析显示,相较于曲妥珠单抗组,T-DM1组患者的3年DFS率显著提高了11.3%(77.0% vs 88.3%,HR0.50,95% CI 0.39~0.64),乳腺癌侵袭性复发风险或死亡的概率降低了50%。
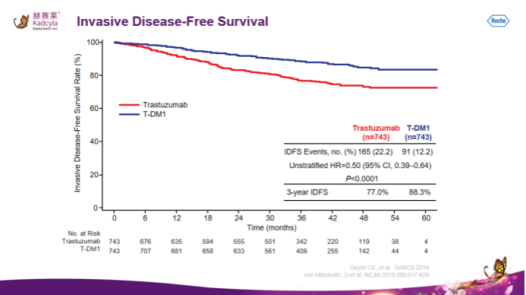
2021年6月23日,基于Ⅲ期EMILIA研究,国家药品监督管理局(NMPA)正式批准罗氏的ADC药物赫赛莱:registered:(英文商品名:Kadcyla:registered:,通用名:恩美曲妥珠单抗,T-DM1)适用于HER2阳性晚期乳腺癌。
EMILIA为随机、国际、非盲的Ⅲ期研究,共入组991例≥18岁、局部晚期或转移性乳腺癌、HER2阳性、无法切除、既往曲妥珠单抗和紫杉类治疗失败的男性和女性患者。入组的患者按1∶1随机分配,接受静脉注射T-DM1或口服对照药物(卡培他滨+拉帕替尼)。在第二次中期分析总生存期OS时超越了预设的总生存有效性分界线后,允许患者从对照组交叉至T-DM1组治疗。
结果显示,T-DM1组的中位PFS是9.6个月,拉帕替尼+卡培他滨组为6.4个月(HR=0.65,95%CI:0.55-0.77,P<0.001);T-DM1组的中位OS是29.9个月,拉帕替尼+卡培他滨组为25.9个月(HR=0.75,95%CI:0.64-0.88,描述性分析无P值)。第二次中期总生存分析后,在对照组(n=496)中有136例(27%)患者交叉至T-DM1组。
2.维布妥昔单抗(靶向CD30)
2020年5月,维布妥昔单抗获得国家药监局批准上市,用于治疗复发性/难治性CD30阳性霍奇金淋巴瘤(HL)或系统性间变性大细胞淋巴瘤(sALCL)。这是国内获批的第2款ADC药物,也是首个靶向CD-30的ADC药物。
维布妥昔单抗在中国的获批是基于三项临床研究SG035-0004、SG035-0003、C25007的数据。其中,在SG-035-0004研究中,针对复发或难治性间变大细胞淋巴瘤,58例患者中97%的患者可实现肿瘤缩小,其5年生存率提高至60%;

在SG035-0003研究中,94%的患者可实现肿瘤缩小,其中位总生存期(OS)从历史27.6个月提升至40.5个月;
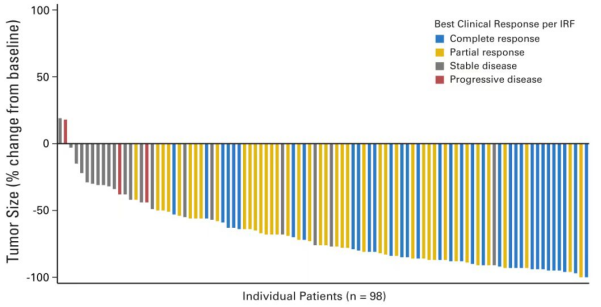
在C25007研究中,在既往至少接受一次化疗方案且开始维布妥昔单抗治疗时不适合进行干细胞移植(SCT)或多药化疗的复发或难治性经典型霍奇金淋巴瘤患者(n=60)中,客观缓解率(ORR)为50%(95% CI,37: 63%)。
2021年4月,中国国家药品监督管理局(NMPA)正式批准注射用维布妥昔单抗两项新适应症,用于治疗CD30阳性的既往接受过系统性治疗的原发性皮肤间变性大细胞淋巴瘤或蕈样真菌病成人患者。此次获批将这款ADC新药的适应症增加至三个。
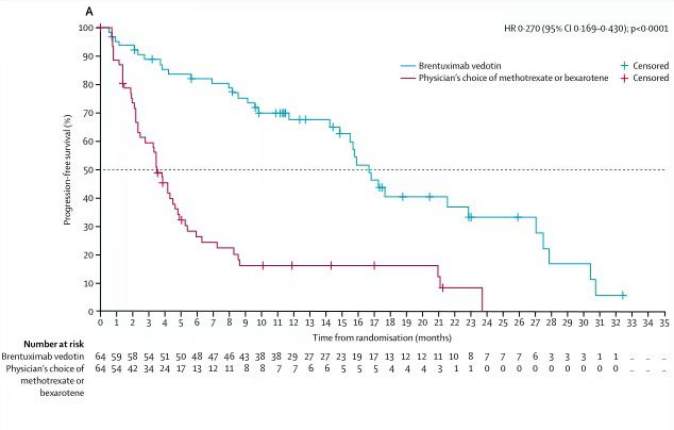
本次新适应症的获批主要基于一项III期、随机、开放标签、多中心临床研究。根据独立评审委员会评估数据显示,研究主要终点和次要终点均显示维布妥昔单抗组疗效优于对照组:与对照组相比,维布妥昔单抗组持续4个月客观缓解率(ORR)显著改善(56.3% vs.12.5%);在关键次要终点方面,维布妥昔单抗组表现出高度统计学意义的显著优势,完全缓解率(CR)更高(15.6% vs.1.6%),无进展生存(PFS)显著改善,中位PFS 为16.7个月(vs.3.5个月)。
3、维迪西妥单抗(靶向HER2)
2021年6月国家药监局(NMPA)宣布,批准荣昌生物注射用维迪西妥单抗(商品名:爱地希)上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。维迪西妥单抗是首款由中国公司自主研发的ADC。
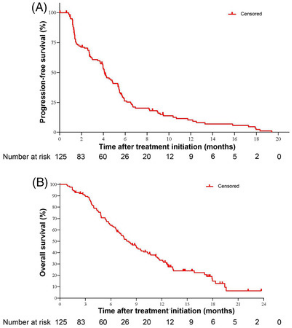
此次获批是基于C008研究结果,对于≥2线标准治疗失败的HER2 IHC2+/3+晚期胃癌患者,接受维迪西妥单抗药物治疗的ORR达到24.8%,疾病控制率(DCR)达42.4%,中位无进展生存期(PFS)为4.1个月,中位OS达到7.9个月【1】。
4、奥加伊妥珠单抗(靶向CD22)
2021年12月22日,国家药监局(NMPA)宣布,辉瑞靶向CD22的ADC疗法注射用奥加伊妥珠单抗获批,用于复发或难治性前体B细胞急性淋巴细胞性白血病的成年患者。
该批准基于了 3 期 INO-VATE ALL 试验的结果,共纳入 326 例成人复发或难治性 B 细胞 ALL 患者,比较了奥加伊妥珠单抗与标准化疗的疗效与安全性。结果显示,与标准化疗相比,奥加伊妥珠单抗能显著提高患者的CR率(80.7% vs 29.4%)【2】。奥加伊妥珠单抗组患者的中位数总生存期(mOS)为 7.7 个月(95% CI:6.0 个月-9.2 个月),化疗组的数据为 6.2 个月(95% CI:4.7 个月-8.3 个月)【3】。
5、戈沙妥珠单抗(靶向Trop-2)
2022年6月7日,中国国家药品监督管理局(NMPA)正式批准靶向Trop-2的戈沙妥珠单抗上市,用于治疗接受过至少两种系统治疗(其中至少一种为针对转移性疾病的治疗)的不可切除的局部晚期或转移性三阴性乳腺癌成年患者,成为国内首个上市的Trop-2靶向疗法。
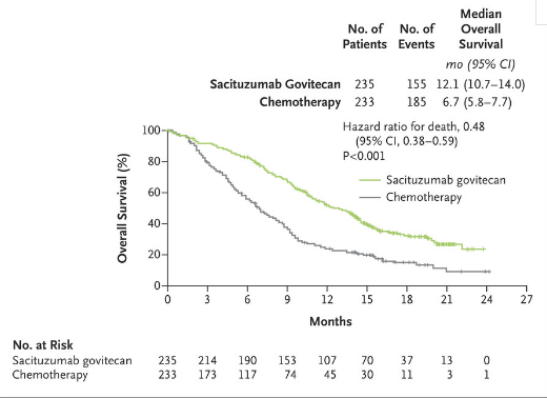
戈沙妥珠单抗的获批基于ASCENT研究和EVER-132-001研究。ASCENT研究中,对比化疗组,戈沙妥珠单抗组显著延长中位PFS(5.6个月 vs 1.7个月)并提升了患者OS(12.1个月 vs 6.7个月),降低了61%的疾病进展或死亡风险【4】。
在中国进行的一项EVER-132-001研究中,ORR达38.8%,与ASCENT研究显示的结果一致,意味着在中国人群中具有相似的疗效【5】。
6、DS-8201(靶向HER2)
2023年2月24日,中国国家药监局(NMPA)官网最新公示,阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)联合开发的注射用德曲妥珠单抗(Enhertu,DS-8201, T-DXd)正式在中国获批上市。适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
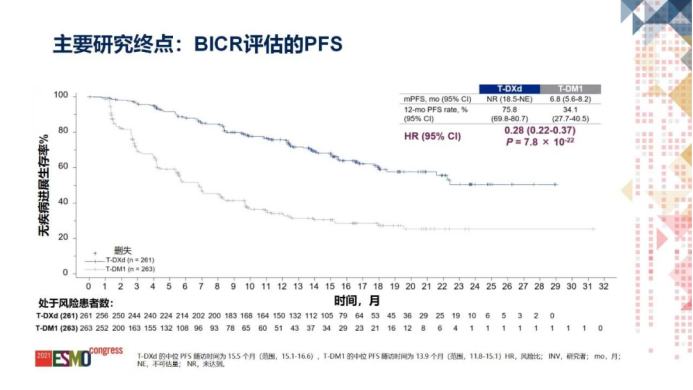
本次获批是基于3期临床试验DESTINY-Breast03的积极结果。DESTINY-Breast03是一项随机、开放、注册全球3期临床试验,旨在头对头评估德曲妥珠单抗相较于恩美曲妥珠单抗(靶向HER2的ADC,T-DM1)治疗HER2阳性、既往接受过曲妥珠单抗和紫杉类药物治疗的不可切除和/或转移性乳腺癌患者的安全性和有效性。与T-DM1相比,T-DXd将患者的疾病进展或死亡风险降低了72%(HR=0.28;95% CI 0.22-0.37;p<0.0001),如此显著的PFS改善在乳腺癌领域的临床研究中前所未有。
参考文献:
1.Peng Z, Liu T, Wei J, et al. Efficacy and safety of a novel anti-HER2 therapeutic antibody RC48 in patients with HER2-overexpressing, locally advanced or metastatic gastric or gastroesophageal junction cancer: a single-arm phase II study. Cancer Commun (Lond).2021;41(11):1173-1182.
2.Kantarjian HM, DeAngelo DJ, Stelljes M, Martinelli G, Liedtke M, Stock W, Gökbuget N, O'Brien S, Wang K, Wang T, Paccagnella ML, Sleight B, Vandendries E, Advani AS. Inotuzumab Ozogamicin versus Standard Therapy for Acute Lymphoblastic Leukemia. N Engl J Med. 2016 Aug 25;375(8):740-53. doi: 10.1056/NEJMoa1509277. Epub 2016 Jun 12. PMID: 27292104; PMCID: PMC5594743.
3.Kantarjian HM, DeAngelo DJ, Stelljes M, Liedtke M, Stock W, Gökbuget N, O'Brien SM, Jabbour E, Wang T, Liang White J, Sleight B, Vandendries E, Advani AS. Inotuzumab ozogamicin versus standard of care in relapsed or refractory acute lymphoblastic leukemia: Final report and long-term survival follow-up from the randomized, phase 3 INO-VATE study. Cancer. 2019 Jul 15;125(14):2474-2487. doi: 10.1002/cncr.32116. Epub 2019 Mar 28. PMID: 30920645; PMCID: PMC6618133.
4.Bardia A, Hurvitz SA, Tolaney SM, Loirat D, Punie K, Oliveira M, Brufsky A, Sardesai SD, Kalinsky K, Zelnak AB, Weaver R, Traina T, Dalenc F, Aftimos P, Lynce F, Diab S, Cortés J, O'Shaughnessy J, Diéras V, Ferrario C, Schmid P, Carey LA, Gianni L, Piccart MJ, Loibl S, Goldenberg DM, Hong Q, Olivo MS, Itri LM, Rugo HS; ASCENT Clinical Trial Investigators. Sacituzumab Govitecan in Metastatic Triple-Negative Breast Cancer. N Engl J Med. 2021 Apr 22;384(16):1529-1541. doi: 10.1056/NEJMoa2028485. PMID: 33882206.
5.Xu B, Ma F, Wang T, Wang S, Tong Z, Li W, Wu X, Wang X, Sun T, Pan Y, Yao H, Wang X, Luo T, Yang J, Zeng X, Zhao W, Cong XJ, Chen J. A Phase IIb, single arm, multicenter trial of sacituzumab govitecan in Chinese patients with metastatic triple-negative breast cancer who received at least two prior treatments. Int J Cancer. 2023 Jan 9. doi: 10.1002/ijc.34424. Epub ahead of print. PMID: 36621000.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言