BMC Med:阿尔茨海默症病患者外周血的细胞转录改变
2022-11-26 brainnew神内神外 brainnew神内神外 发表于安徽省
AD患者外周血中不同免疫细胞类型比例的变化以及单个细胞类型内在表达的变化。研究人员观察到,与对照组相比,AD和MCI参与者的独立队列中中性粒细胞比例和NLR持续增加。
阿尔茨海默症(AD)是一种进行性神经退行性疾病,是世界范围内痴呆症最常见的原因。累积的数据表明外周免疫系统在AD发病机制中的作用。然而,对AD患者外周免疫细胞的分子特征缺乏全面的了解。为了探讨外周血中细胞组成的变化和单个细胞类型基因表达的变化,研究人员在大规模批量血液表达队列中使用算法进行计算,并通过调整细胞比例确定了单个细胞类型的差异表达基因。研究人员分别检测到AD血液中性粒细胞和B淋巴细胞的比例分别显著增加和减少,这在其他三个AD队列中具有可重现性。AD中性粒细胞中的差异表达基因富集到一些AD相关通路,如ATP代谢过程和线粒体。
研究人员还发现,在AD风险基因(包括CD33和IL1B)的中性粒细胞中,白细胞的细胞相互作用激活、线粒体和细胞因子介导的信号通路的蛋白质相互作用网络模块显著富集。细胞组成和特定基因表达水平的变化与临床和病理改变显著相关。轻度认知障碍(MCI)患者也可观察到中性粒细胞的细胞比例和基因表达水平的类似紊乱模式。此外,研究人员注意到AD大脑中性粒细胞丰度增加。综上,本研究揭示了AD细胞水平的分子扰乱图谱。这些变化突出了中性粒细胞在AD病理生物学中的作用。
论文ID
原名:Cellular transcriptional alterations of peripheral blood in Alzheimer’s disease
译名:阿尔茨海默症患者外周血的细胞转录改变
期刊:BMC Medicine
IF:11.15
发表时间:2022年8月
通讯作者:赵兴明
通讯作者单位:复旦大学类脑智能科学与技术研究院
DOI号:10.1186/s12916-022-02472-4
实验设计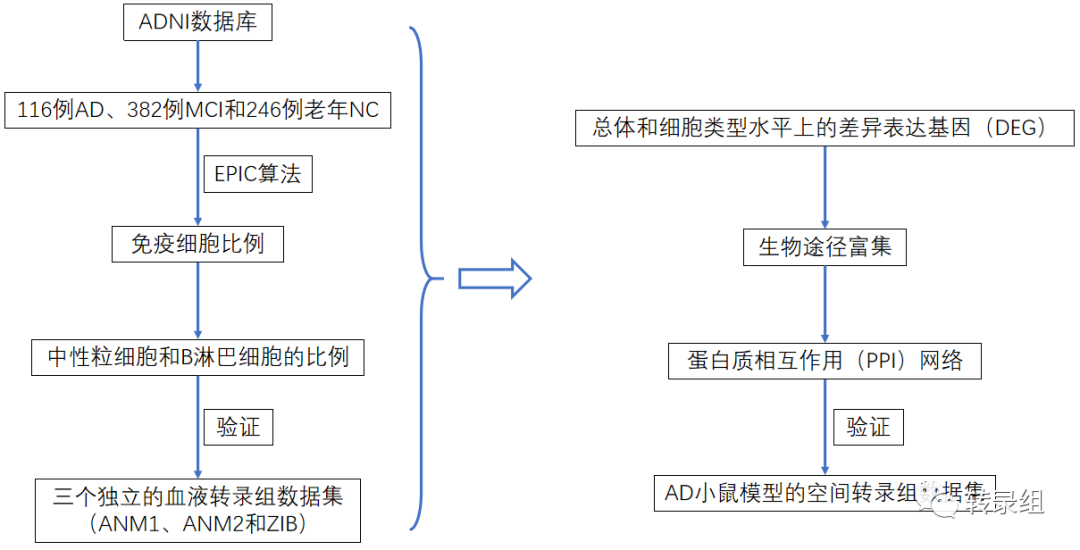 AD患者免疫细胞比例的改变
AD患者免疫细胞比例的改变
研究人员从ADNI数据库中的个体获得了血源性基因表达数据,包括116例AD、382例MCI和246例老年NC。研究人员首先应用EPIC算法,利用参考免疫细胞类型的基因表达谱来估计这些样本的免疫细胞比例(图1A)。研究人员发现AD患者的B细胞比例明显低于NC患者和MCI,而AD中性粒细胞的比例明显高于NC。然后,研究人员使用中性粒细胞与淋巴细胞比率(NLR),即外周血中性粒细胞和淋巴细胞计数之间的比率,来评估这些样本的中性粒细胞介导的全身炎症。研究人员发现,与对照组相比,AD患者的NLR显著增加(图1B)。为了进一步验证这一观察结果,研究人员还使用三种计算工具(即quanTIseq、CIBERSORT和MCP-counter)估计了其他三个独立的血液转录组数据集(即ANM1、ANM2和ZIB)中的免疫细胞比例。正如预期的那样,研究人员发现,除CIBERSORT下的ANM2数据集外,使用不同的计算工具时,大多数数据集中AD的NLR显著高于NC(图1B)。尽管在大多数测试中,MCI和NC之间的NLR差异在统计上并不显著,但研究人员仍然可以观察到AD与NC之间的相同趋势。总的来说,这些发现表明AD和MCI的炎症反应比NC的炎症反应高。
然后,研究人员对这些样本中的免疫细胞比例进行主成分分析(PCA)。前两个主成分(PC)占样本中免疫细胞比例总方差-协方差的59.9%。中性粒细胞(阴性)和B细胞(阳性)对PC1(总方差-协方差的35%)的贡献最大(图1C)。PC2(占总方差-协方差的24.9%)在CD8+和CD4+T细胞上的权重最强。PCA散点图显示,大多数AD患者的免疫细胞特征无法与对照组的免疫细胞相区分(图1C),但其中一部分患者的PC1阳性分数较低,即B细胞比例明显较低和/或中性粒细胞比例增加,表明这些样本中的适应性活性较低和(或)先天性和促炎症活性较高。
然后,研究人员评估了NC和AD参与者的免疫细胞比例、认知、疾病诊断、早期检测AD的大脑结构特征(源自MRI数据)与人口统计学变量之间的相关性(图1D)。与上述结果一致,NLR和中性粒细胞比例与疾病诊断呈正相关,而与海马和左侧内嗅皮质体积以及认知功能呈负相关(图1D)。当使用所有AD、MCI和NC个体进行评估时,可以观察到类似的相关性模式。此外,研究人员注意到细胞比例和NLR可能受年龄和性别的影响(图1D)。考虑到不同诊断组之间的年龄和性别差异可能是重要的因素,因此,研究人员通过调整两个因素(即年龄和性别),在疾病状态和细胞比例之间进行了逻辑回归。调整因素后,尽管统计显著性水平降低,但中性粒细胞和B细胞的比例仍分别与ADNI数据集中的AD状态呈显著正相关和负相关。研究人员还在ANM1和ANM2数据集中确认了这些结果。研究人员观察到中性粒细胞和B细胞的比例与MCI状态之间存在相同的方向,但无显著相关性。此外,校正年龄和性别的因素后,MCI和AD之间的CD4+T细胞比例差异没有统计学意义。与之前的研究一致,这些结果表明,除了年龄和性别因素外,AD的发生在一定程度上推动了中性粒细胞比例和NLR的增加。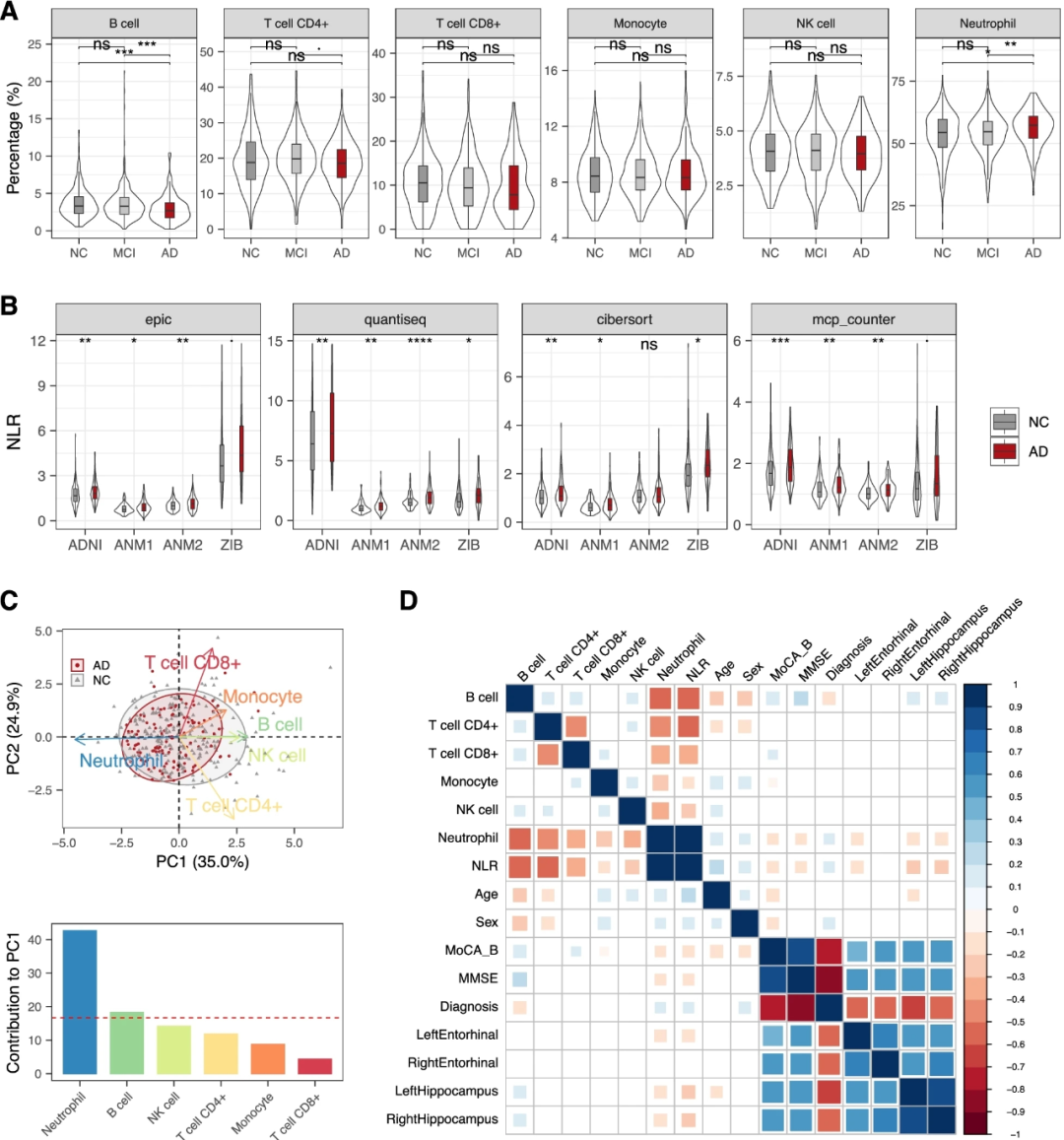 图1.AD患者的外周免疫细胞比例。A、MCI、AD患者和对照组中六种外周血免疫细胞的细胞比例分布。B、不同计算工具下不同数据集AD和NC中性粒细胞与淋巴细胞比率(NLR)的比较。C、AD和NC参与者细胞比例的主成分分析(PCA)。D、免疫细胞比例、诊断、认知测量、脑面积和人口统计学变量之间的相关性。
图1.AD患者的外周免疫细胞比例。A、MCI、AD患者和对照组中六种外周血免疫细胞的细胞比例分布。B、不同计算工具下不同数据集AD和NC中性粒细胞与淋巴细胞比率(NLR)的比较。C、AD和NC参与者细胞比例的主成分分析(PCA)。D、免疫细胞比例、诊断、认知测量、脑面积和人口统计学变量之间的相关性。
AD中细胞类型的差异表达基因
通过调整共建因子,线性回归在每个数据集中确定AD的差异表达基因(DEG)(图2A),其中与使用Wilcoxon检验确定的基因有显著重叠和强一致性,证实了结果的可靠性。与免疫细胞比例的变化和之前的研究一致,研究人员发现AD中的大量上调和下调基因在四分之三的数据集中分别显著富集于中性粒细胞活化/脱颗粒和B/T细胞受体信号通路(图2B,C)。研究人员还观察到ANM1和ANM2数据集中MCI中性粒细胞活化/脱颗粒的下调和RNA分解代谢过程的上调。
为了进一步检查单个免疫细胞类型的内在表达变化,研究人员通过调整ADNI数据集中的细胞比例和共建因子来确定每个细胞类型中的DEG(图2D)。研究人员比较了总体DEG和细胞类型的DEG,发现细胞类型中只有一小部分DEG与总体DEG重叠。研究人员注意到,六种细胞类型中有四种(即中性粒细胞、单核细胞、NK细胞和CD4+T细胞)与大量DEG有显著重叠;中性粒细胞的重叠最强,这可能是由于外周血中这种细胞类型的高丰度(55-70%)所致。
接下来,研究人员从ADNI数据集中探讨了AD患者外周免疫细胞类型中受干扰的生物途径的共享性。如图2E所示,所有或大多数细胞类型中的失调基因与免疫反应调节、防御反应调节、细胞对细胞因子刺激的反应以及炎症反应调节有关,这与单细胞测序分析揭示的AD外周血单核细胞中常见的失调信号一致。此外,研究人员观察到一些生物过程中的细胞类型特异性中断,例如,B细胞中的Ras蛋白信号转导、NK细胞中细胞迁移的正调节、CD4+T细胞中生物矿化的调节、抗原处理和单核细胞的呈现。有趣的是,研究人员发现中性粒细胞中的DEG在ncRNA代谢过程、多肽和ATP代谢过程、核糖体亚单位生物生成和线粒体组织中显著富集,这些也在整体水平下调,表明中性粒细胞可能是外周转录组学改变的主要因素。据报道,线粒体功能障碍和能量低代谢是AD和MCI中最常见和最早的异常之一,可能与Aβ的产生有关,突出了中性粒细胞在AD病理生物学中的潜在作用。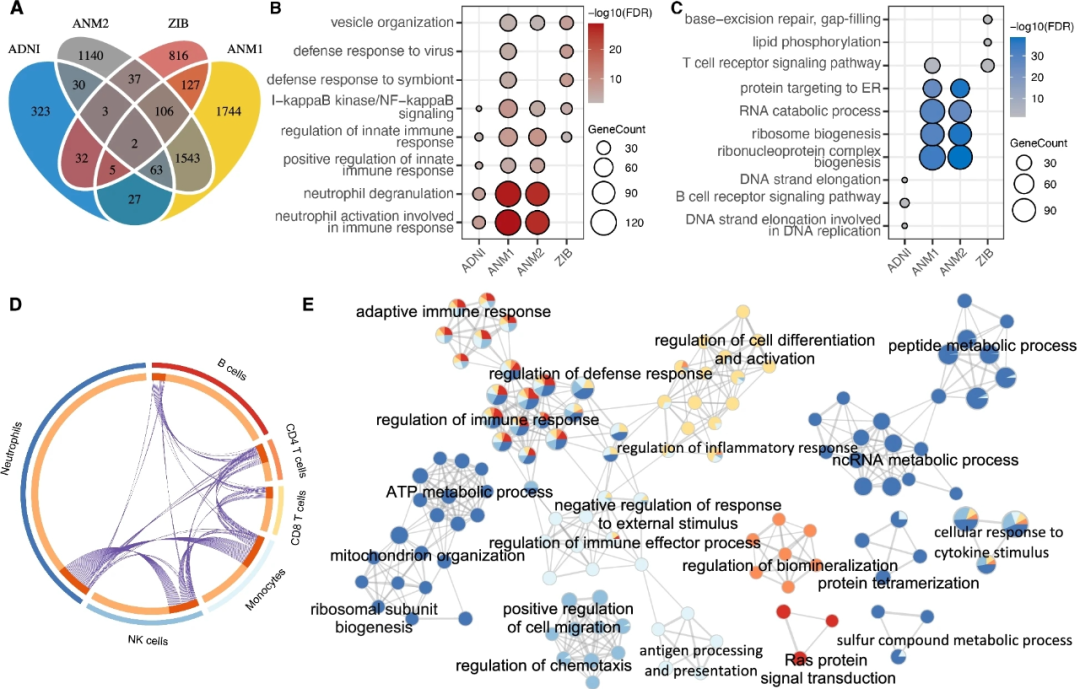 图2.AD在总体和细胞类型水平上的差异表达基因(DEG)。A、韦恩图显示了四个血液转录组数据集中大量DEG的重叠。B,C、与每个数据集中的NC相比,AD中上调(B)和下调(C)基因的最高富集生物过程。D、圆形图显示ADNI中每个细胞类型的DEG基因之间的重叠。E、ADNI中每个细胞类型的富集网络。
图2.AD在总体和细胞类型水平上的差异表达基因(DEG)。A、韦恩图显示了四个血液转录组数据集中大量DEG的重叠。B,C、与每个数据集中的NC相比,AD中上调(B)和下调(C)基因的最高富集生物过程。D、圆形图显示ADNI中每个细胞类型的DEG基因之间的重叠。E、ADNI中每个细胞类型的富集网络。
中性粒细胞中AD风险基因的富集
蛋白质相互作用(PPI)网络可以帮助阐明控制信号输出的生化复合物或信号转导成分。鉴于中性粒细胞在AD发病机制中的功能,研究人员使用Metascape重建中性粒细胞中DEG的PPI网络。研究人员确定了密集连接的模块(最小为三个蛋白),它们代表特定的分子复合物和功能(图3A)。例如,最重要的模块#1富含核糖核蛋白复合物的生物发生,包括核糖体蛋白家族,如RPL35、RPL7A和RPL6。模块#2和#3富含细胞因子介导的信号,包括白细胞介素(IL)和肿瘤坏死因子(TNF)。研究人员还观察到其他模块#3、#4和#5的具有生物学意义的功能,包括ATP代谢过程、线粒体转运和与线粒体组织相关的线粒体外膜。
为了确认模块与AD发病机制相关,研究人员评估了AD遗传风险基因集或来自不同来源的AD相关基因集模块中的基因富集情况(图3B)。研究人员发现,模块#2和#3在多个AD相关基因集中显著富集。模块#2主要在白细胞细胞粘附和活化的调节中表现出富集。有趣的是,研究人员发现模块#2中的两个中心基因IL1B(编码白细胞介素1细胞因子家族的促炎症成员)和FAS(编码TNF受体超家族)在AD的中性粒细胞中上调(图3B)。研究人员还注意到,模块#3(线粒体组织和细胞因子介导的信号通路相关模块)在GWAS和大型LOAD联合数据集的荟萃分析中显著富集了AD遗传风险基因。例如,CD33的表达水平与海马和内嗅皮质体积呈正相关。在之前的研究中,有报道称CD33可能在脑内小胶质细胞介导的Aβ清除和神经炎症通路中发挥重要作用,其结构变异和SNP与AD的高风险相关。此外,研究人员想注意到CD33是模块#3中具有高聚类系数的中心基因之一。这些结果强调了中性粒细胞模块#3在AD发病机制中的功能。
然后,研究人员对中性粒细胞中的DEG进行了生物过程富集分析。研究人员发现AD和NC中线粒体组织受到抑制,细胞因子介导的信号通路和炎症反应被激活。为了验证中性粒细胞信号通路的中断,研究人员进一步使用从不同数据集确定的DEG进行了通路富集分析(图3C-D)。虽然来自不同数据集的DEG显示出有限的重叠(图3C),但研究人员想强调至少三个队列中富集途径类别的收敛,包括代谢过程、免疫系统过程和对刺激的反应(图3D)。此外,研究人员在不同队列中观察到MCI中类似的富集途径模式(图3E)。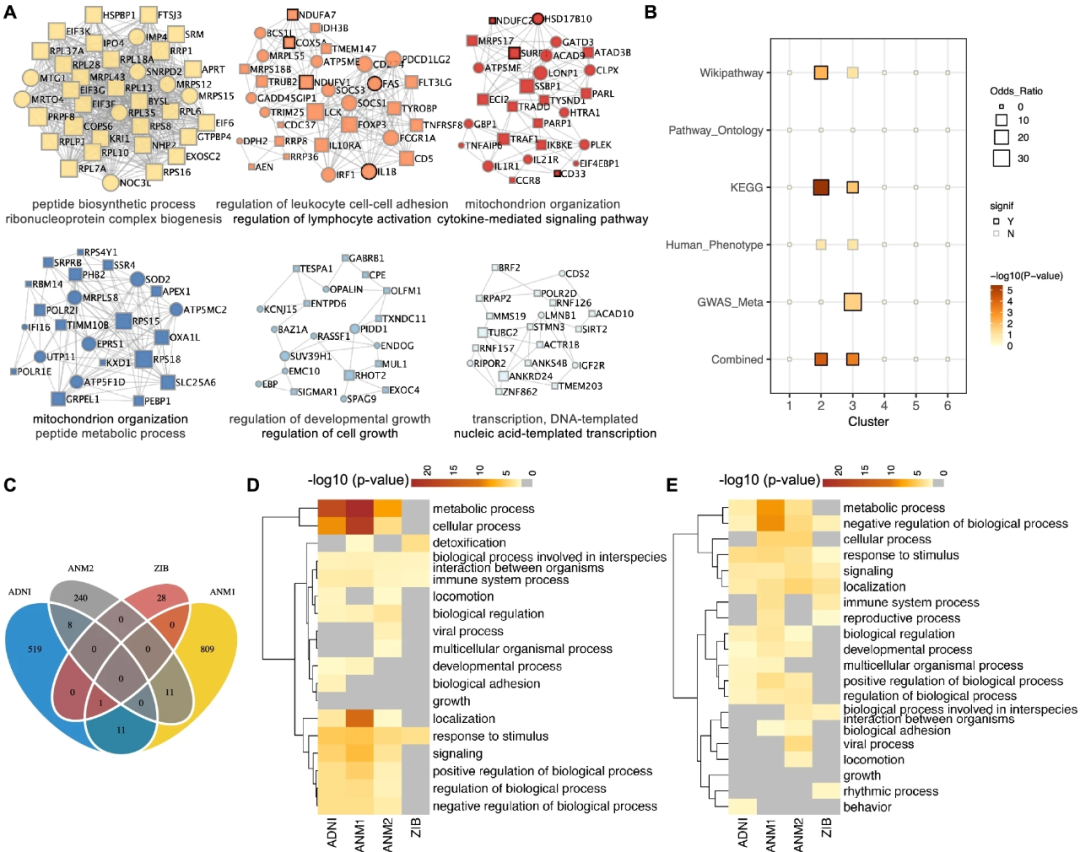 图3.中性粒细胞中蛋白质-蛋白质相互作用网络。A、AD中性粒细胞中DEG的蛋白质-蛋白质相互作用网络和MCODE模块。B、AD相关基因列表中每个模块的富集。C、韦恩图显示了四组血液转录组数据中AD和NC中性粒细胞中DEG的重叠。D,E、四个数据集中AD(D)和MCI(E)中DEG的富集途径的热图。
图3.中性粒细胞中蛋白质-蛋白质相互作用网络。A、AD中性粒细胞中DEG的蛋白质-蛋白质相互作用网络和MCODE模块。B、AD相关基因列表中每个模块的富集。C、韦恩图显示了四组血液转录组数据中AD和NC中性粒细胞中DEG的重叠。D,E、四个数据集中AD(D)和MCI(E)中DEG的富集途径的热图。
AD脑中性粒细胞升高
证据表明,血脑屏障(BBB)的功能障碍和恶化可能通过Aβ积累的反馈回路在AD发病机制中发挥关键作用,并加速认知障碍和痴呆的发病。在AD患者和动物模型的大脑中也发现了血液衍生的白细胞亚群,如淋巴细胞和单核细胞。
为了检查中性粒细胞是否渗入AD大脑,研究人员使用97名AD患者和105名对照者的转录组数据集估计了AD大脑中性粒细胞的比例和丰度。与中性粒细胞向大脑的外渗迁移一致,研究人员观察到AD大脑中小脑(CBE)和颞皮质(TCX)中性粒细胞的绝对丰度显著增加(图4A)。研究人员还发现,中性粒细胞的丰度与两个大脑区域的神经纤维分期评分(图4B)和淀粉样期(图4C)呈显著正相关。然而,研究人员没有观察到AD和NC之间中性粒细胞比例的显著差异,这可能是由于大脑免疫细胞(例如小胶质细胞和星形胶质细胞)的大量升高。此外,研究人员在AD小鼠模型的空间转录组数据集中量化了中性粒细胞的丰度(即3个月、6个月、12个月和18个月)。正如预期的那样,研究人员发现,在晚期(即12个月和18个月),而不是早期(3个月和6个月)海马(HP)和皮质(CX)中性粒细胞的丰度均显著增加(图4D-E)。
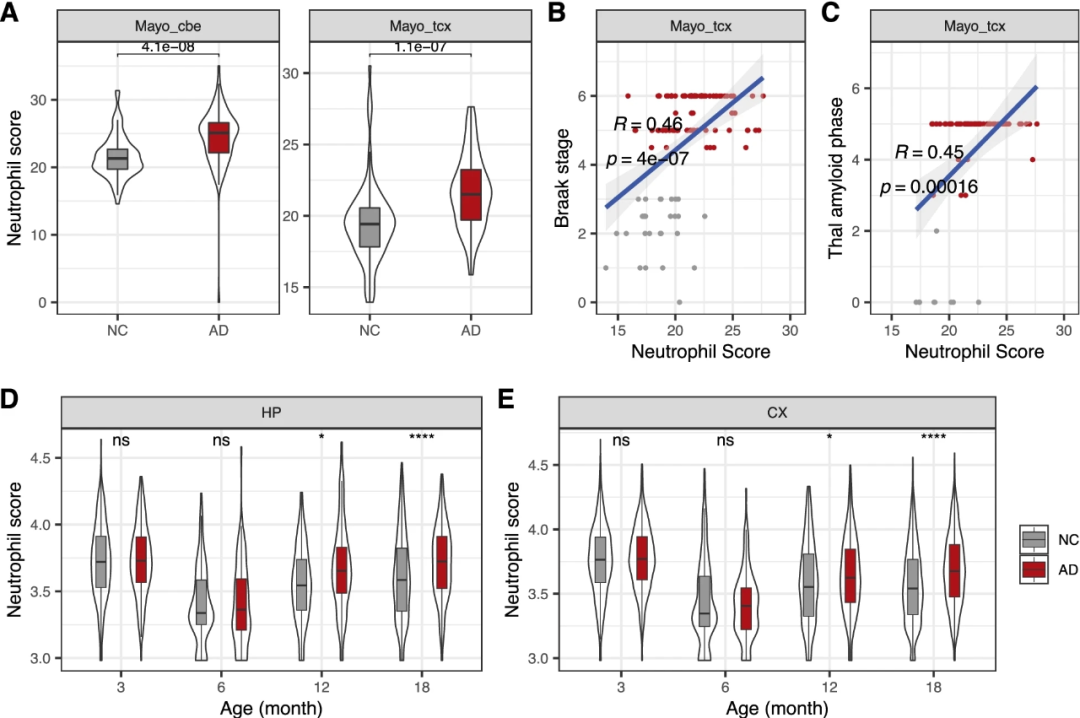 图4.AD脑内中性粒细胞的丰度。A、AD患者和对照组小脑(CBE)和颞皮质(TCX)中性粒细胞绝对丰度的比较。B、颞皮质中性粒细胞丰度评分和神经纤维分期评分之间的相关性。C、中性粒细胞丰度评分和淀粉样蛋白评分之间的相关性。D,E、不同年龄AD和NC模型小鼠海马(D)和大脑皮层(E)中性粒细胞绝对丰度的比较。
图4.AD脑内中性粒细胞的丰度。A、AD患者和对照组小脑(CBE)和颞皮质(TCX)中性粒细胞绝对丰度的比较。B、颞皮质中性粒细胞丰度评分和神经纤维分期评分之间的相关性。C、中性粒细胞丰度评分和淀粉样蛋白评分之间的相关性。D,E、不同年龄AD和NC模型小鼠海马(D)和大脑皮层(E)中性粒细胞绝对丰度的比较。
讨论
在本研究中,研究人员首先对AD、MCI和NC的大规模批量外周血转录组队列进行分析。然后,研究人员比较了这些组中免疫细胞的细胞比例,并使用独立的三个血液转录组数据集和其他计算工具进一步验证了结果。接下来,研究人员估计了免疫细胞类型的细胞固有DEG。研究人员确定了这些免疫细胞类型之间的细胞类型特异性和共享信号通路。研究人员还为中性粒细胞中的DEG重新构建了蛋白质-蛋白质相互作用网络,并确定了几个与AD发病机制相关的模块。最后,研究人员发现免疫细胞在AD大脑中的渗透性增强。
研究人员发现,与NC相比,AD患者中性粒细胞和B淋巴细胞的比例分别显著增加和减少,这与AD患者的NLR升高一致。研究人员观察到中性粒细胞比例和NLR与AD磁共振成像(MRI)生物标记物和认知测量呈负相关,即使调整了年龄和性别的因素,也与AD状态呈负相关。中性粒细胞是人类外周血中最丰富的白细胞类型,被认为是抵抗感染性病原体的先天免疫的关键元素。外周血中的NLR反映了全身炎症和适应性免疫之间的平衡。因此,AD中性粒细胞和NLR的升高表明全身炎症反应在AD发病机制中的潜在作用。有趣的是,研究人员注意到MCI患者的NLR高于NC患者,这表明这种生物医学测量方法可以作为AD早期诊断的有力指标。此外,之前对AD小鼠模型的研究表明,外周血中的中性粒细胞可以粘附脑毛细血管并阻断皮质血流,通过整合素LFA-1渗入脑实质,最终促进BBB的损伤。因此,研究人员注意到,在AD早期和晚期,多个脑区中性粒细胞的丰度增加,中性粒细胞丰度与AD病理改变呈正相关。
鉴于线粒体功能障碍和代谢减少对认知能力下降和Aβ沉积的影响,中性粒细胞代谢过程和线粒体组织的特异性下调突出了中性粒细胞在AD进展中的作用。此外,研究人员注意到,中性粒细胞中线粒体组织、细胞因子介导的信号通路和白细胞-细胞粘附的网络模块在AD风险或相关基因中显著富集。具体而言,与对照组相比,AD患者中性粒细胞中某些促炎细胞因子和受体(例如IL1B、IL1R1、IL21R和TNFAIP6)的表达显著上调。这些细胞因子可以靶向小胶质细胞和脑内皮细胞,导致小胶质细胞活化增加,BBB的通透性和转运分别改变。此外,CD33是未成熟中性粒细胞的生物标记物,在AD中性粒细胞中下调,与AD中性粒细胞脱颗粒升高一致。此外,中性粒细胞氧化磷酸化亚基基因(如NDUFC2、NDUFA7和NDUFV1)的表达降低,反映了AD脑中的线粒体功能障碍。这些结果表明中性粒细胞分子变化在AD发病机制中的潜在作用。
大量上调基因的中性粒细胞脱颗粒富集与中性粒细胞比例增加之间存在一致性。此外,对于大多数免疫细胞类型,尤其是中性粒细胞,大量DEG和固有DEG之间存在显著重叠。这表明大量转录组改变是由细胞比例和丰度以及细胞表达变化共同驱动的。尽管存在显著重叠,但每种细胞类型的大多数DEG均未在总体水平上检测到,这突显了识别细胞固有DEG对于开发诊断生物标记物的重要性。此外,研究人员注意到,DEG在不同队列之间显示出有限的重叠(图3C),也与从单细胞测序数据集确定的重叠有限,这可能是由于样品制备、测序方法和分析的差异,以及参与者的异质性。然而,在失调的信号通路中存在着趋同,例如防御反应的调节失调、细胞对细胞因子刺激的反应失调以及大多数细胞类型的炎症反应失调,这表明通路和基于网络的标记物可能更为稳健。
尽管通过细胞比例和细胞分子变化获得了生物学见解,但也存在一些局限性。首先,在进行差异表达分析和逻辑回归分析时,研究人员调整了年龄和性别的共同协变量。然而,免疫细胞计数和外周血的表达谱容易受到隐藏因素的影响,如共病、临床和生活方式因素。其次,AD是一种具有不同病理生理机制的异质性疾病。因此,脑转录组数据揭示了与多种失调通路的不同组合相对应的分子亚型,例如对tau介导的神经变性、Aβ神经炎症、突触信号、免疫活性和线粒体组织的敏感性。因此,本研究中发现的变化可能反映了异质样本的平均信号。最后,目前还没有关于AD中性粒细胞的单细胞测序数据。尽管细胞比例的变化和富集的信号通路在多个独立的数据集中可以重现,但缺乏对同一批数据进行单细胞分析的比较,以说明方法的性能。
总之,本研究探讨了AD患者外周血中不同免疫细胞类型比例的变化以及单个细胞类型内在表达的变化。研究人员观察到,与对照组相比,AD和MCI参与者的独立队列中中性粒细胞比例和NLR持续增加。研究人员根据免疫细胞类型中的DEG确定了细胞类型特异性和共享信号通路。然后,研究人员为每种免疫细胞类型中的DEG重新构建PPI网络,并从与AD发病相关的中性粒细胞中识别出几个模块,其分子功能富集于白细胞相互作用激活、线粒体组织和细胞因子介导的信号通路。中性粒细胞丰度的变化和中性粒细胞中相关模块的中心基因表达水平的变化均与AD的病理改变有显著相关性。这项工作突出了中性粒细胞的细胞丰度和表达谱的临床价值,未来,外周血中这些数据的综合分析将有助于监测AD/MCI发病机制,并可能为AD治疗靶点的开发提供新的见解。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






