Immunity:阿尔茨海默病(AD)中的先天性和适应性免疫病理反应
2022-12-28 周科 “神经周K”公众号 发表于上海
目前,AD临床发作期的基本机制还不清楚,治疗效果仍不理想。更好地理解先天性和适应性免疫系统间的联系以及其在AD病理过程(特别是tau病理期)中的作用,有助于提出对临床发作期的新型治疗干预策略。
脊椎动物的免疫防御包括先天性免疫和适应性免疫系统,前者包括树突状细胞、单核细胞、巨噬细胞和自然杀伤T细胞,后者包括T细胞和B细胞。虽然稳态中枢神经系统(CNS)具有相对免疫特权,但同样具备先天性和适应性免疫系统。其中,小胶质细胞作为主要的驻留先天性免疫细胞位于脑实质,其它免疫细胞大多聚集在CNS边界,共同维持CNS正常功能运行。在疾病条件下,非驻留免疫细胞迁移到脑实质,导致其中先天性和适应性免疫生态位重建。
阿尔茨海默病(AD)是最常见的神经退行性疾病,其病理特征是β淀粉样蛋白(Aβ)沉积形成的细胞外斑块和tau蛋白过度磷酸化形成的胞质内神经原纤维缠结(NFTs)导致的神经元、突触丢失和脑萎缩。越来越多证据表明,AD不仅仅是一种蛋白质病,其还涉及小胶质细胞激活和外周免疫细胞浸润大脑等免疫病理。

2022年12月华盛顿大学奈特阿尔茨海默病研究中心的David M. Holtzman在immunity期刊发表的综述重点介绍了AD病理的发生和发展,并全面总结了大脑先天性和适应性免疫系统及其在AD中的作用。
1
AD的病理发展
在临床症状出现之前,AD有一个可长达20年的临床前阶段,其间,Aβ沉积先于Tau病理在新皮层出现。Aβ由分泌酶裂解β-淀粉样前体蛋白(APP)产生,在非病理条件下主要以Aβ40形式存在。在家族性AD中,基因突变促进Aβ和更长Aβ亚型过度产生及聚集。在迟发性AD (LOAD)中,Aβ的清除受阻,较长Aβ亚型形成不溶性高阶低聚物、原丝或原纤维,以斑块形式沉积于脑实质或软脑膜壁和脑血管中,导致神经元结构损伤、血脑屏障损坏、血管系统失调。
Tau病理(而非Aβ沉积)位置与脑萎缩和认知障碍的发生和发展高度相关。在AD中,主要定位于神经元轴突的tau蛋白被过度磷酸化(或乙酰化、泛素化),聚集构成神经原丝和NFTs等结构。AD的tau病理发展表现为Braak分期模式。Aβ和tau病理相互影响,Aβ斑块为tau种子的快速扩增创造环境。解析Aβ和Tau蛋白之间的相互作用,有助于理解疾病进展。
2
AD中的关键先天性免疫信号通路
一系列免疫信号通路在AD病理中发挥重要作用。AD中,小胶质细胞NF-kB信号、NLRP3炎症小体被tau病理激活,抑制NF-kB信号可恢复小胶质细胞稳态,抑制NLRP3信号可促进小胶质细胞吞噬Aβ以减少Aβ斑块、降低tau蛋白过度磷酸化和聚集,并改善空间记忆。
AD病理中,mTOR介导Trem2对小胶质细胞代谢的调控作用,激活小胶质细胞mTOR信号可对Aβ相关的神经损伤提供保护作用。TAM信号在Aβ斑块相关的小胶质细胞中表达丰富,其缺失抑制小胶质细胞对Aβ的吞噬作用,促进脑实质斑块形成。干扰素刺激基因(ISGs)表达上调的小胶质细胞特异性包围Aβ斑块,小胶质细胞特异性IFNAR1缺失可改善AD中的认知缺陷。
3
AD中的关键先天性免疫信号通路
1. AD中大脑免疫生态位保障机制失调
BBB和脑膜等保障机制使稳态脑实质具有相对免疫特权。大量数据表明AD中,免疫保障功能失调,包括血管炎症、血脑屏障功能障碍和脑膜淋巴系统引流受损,重塑大脑免疫状态。
AD中已被发现存在包括通透性增加、微出血、葡萄糖转运减少、P-选择素糖蛋白配体1外排功能受损、Aβ清除障碍和白细胞浸润增加等BBB功能障碍。此外,大脑类淋巴系统关键因子水通道蛋白-4(AQP4)的表达缺陷和定位错误可导致Aβ清除障碍,脑膜淋巴管损伤可加剧Aβ沉积、小胶质细胞增生、神经血管功能障碍并削弱抗Aβ的免疫治疗效果。
2. AD中脑实质先天性免疫生态位的重建
小胶质细胞是促进AD发生和发展的关键细胞成分。在Aβ沉积区域,疾病相关小胶质细胞(DAM)/神经退行性小胶质细胞(MGnD)可限制Aβ病理并抑制其介导的tau扩散,并随着病程发展转变为IFN反应小胶质细胞(IRMs)和高表达主要组织相容性复合体(MHC)II类基因、AD风险基因的激活反应小胶质细胞(ARMs)。
在tau聚集区域,反应性小胶质细胞和DAM/MGnD显示出与tau病理和CNS损伤密切相关的特征性基因表达模式,其消除可显着改善脑萎缩和神经元丢失(图1)。此外,DAM、ARM、IRM还可通过分泌细胞因子及其它机制损伤突触。因此,监测小胶质细胞状态转变以开发针对小胶质细胞的特殊化合物可能是减缓或阻止AD发展的有效策略。
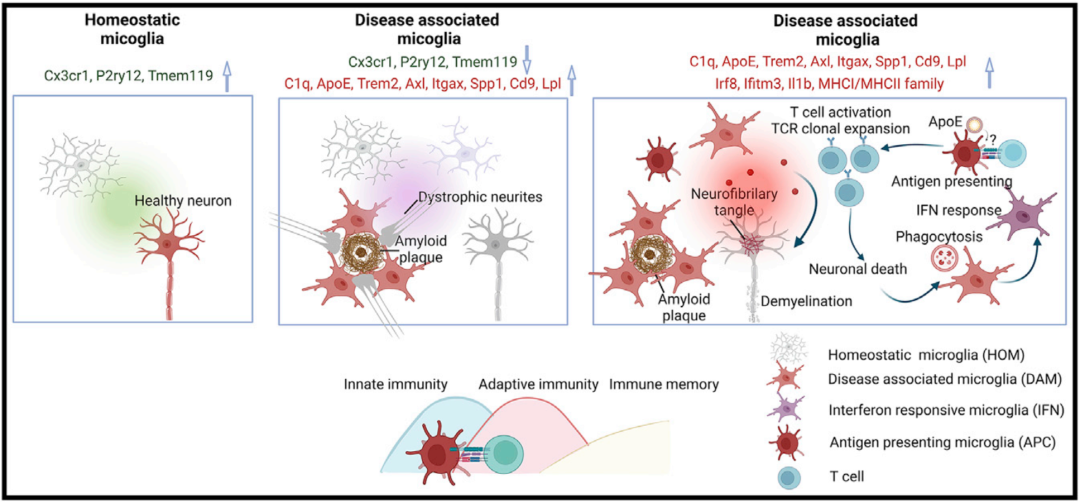
图1. 与AD相关的小胶质细胞状态转变
中性粒细胞和单核细胞已经在AD动物模型和人类大脑中被鉴定出。AD中,中性粒细胞粘附于脑血管,并在LFA-1整合素依赖性粘附介导下迁移到脑实质,消除中性粒细胞或抑制其迁移均可减少斑块形成并改善记忆衰退。抗炎型Ly6Clow单核细胞被吸引并附着在Aβ阳性静脉的腔壁,而选择性消除Ly6Clow单核细胞可诱导Aβ沉积。
3. AD中脑实质适应性免疫生态位的重建
AD脑脊液、脑膜和海马中的T细胞增加,且以CD8+ T细胞为主。AD外周FoxP3+ Treg细胞增加,消除或抑制Treg细胞均可减轻Aβ病理并改善空间学习能力。此外,消除B细胞也可改善Aβ相关病理。对适应性免疫在AD中作用的了解目前仍很匮乏,解析AD发展中适应性免疫变化的时间特征、特异性细胞亚群及潜在免疫介质有助于阐明适应性免疫在AD发生、发展中的作用。
4. AD中先天性免疫和适应性免疫的相互作用
AD大脑驻留细胞可产生细胞因子、活性氧(ROS)和诱导型一氧化氮合酶(iNOS),诱导脑实质神经炎症反应,导致T细胞浸润大脑。同时,脑膜、BBB、血-CSF屏障等脑屏障粘附分子配体和整合素表达增加,允许更多T细胞进入大脑(图2)。这些活化的T细胞分泌促炎和神经毒性介质,使炎症级联持久,并诱导小胶质细胞状态转变,引发或加速脑萎缩。
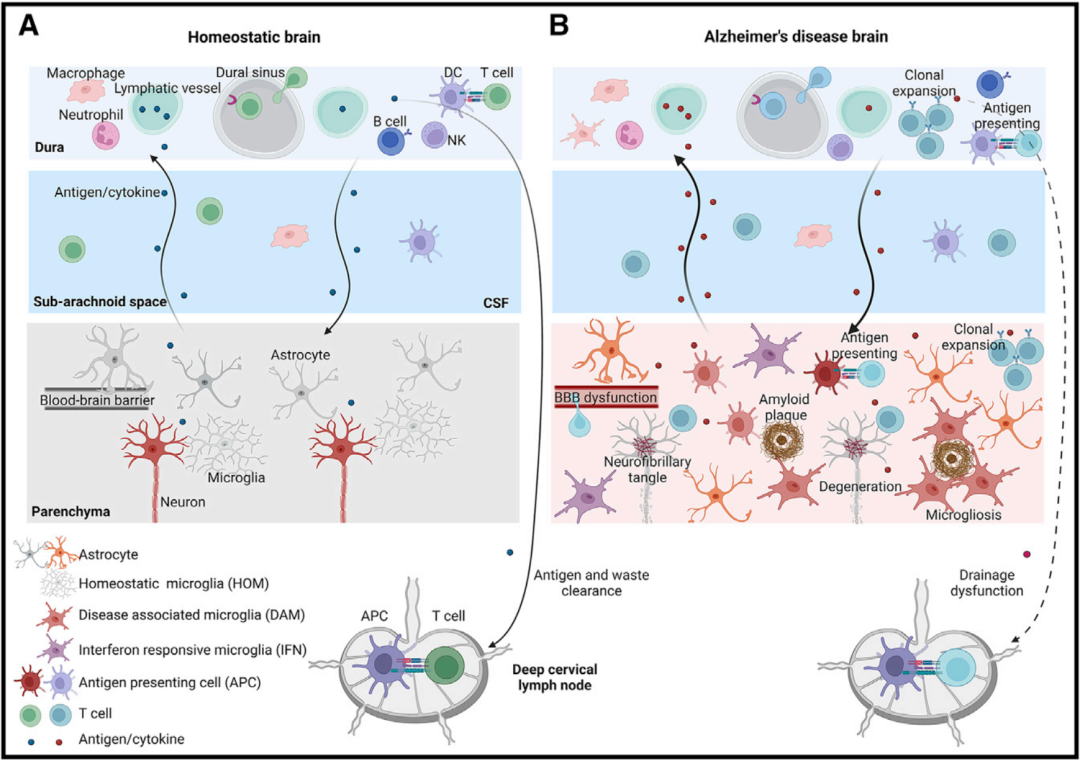
图2. AD大脑中先天性和适应性免疫系统相互作用的概括
5. 外周和大脑之间的交叉对话
外周和大脑存在双向交叉对话,包括迷走神经感觉传入、脑源性物质进入血液并与外周免疫细胞通信、外周免疫细胞或活性因子与脑内小胶质细胞通信,以及外周免疫细胞直接渗透到脑实质。值得注意的是,衰老、糖尿病、昼夜节律和睡眠功能障碍以及肠道微生物群紊乱均已被证实是AD的风险因素。
总结
AD中,Aβ和tau聚集物的沉积及其导致的损伤,诱导脑实质免疫系统激活、大脑边界保障机制失调、外周免疫细胞异位浸润脑实质,引起先天性和适应性免疫环境重建。
目前,AD临床发作期的基本机制还不清楚,治疗效果仍不理想。更好地理解先天性和适应性免疫系统间的联系以及其在AD病理过程(特别是tau病理期)中的作用,有助于提出对临床发作期的新型治疗干预策略。
原始出处:
Xiaoying Chen, David M. Holtzman. Emerging roles of innate and adaptive immunity in Alzheimer’s disease. immunity, 2022.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言