Cell Stem Cell:衰老神经元构成了阿尔兹海默症患者晚年大脑炎症的神经性来源
2022-12-29 brainnew神内神外 brainnew神内神外 发表于安徽省
衰老(senescence)是一种局限于增殖细胞的现象,这一概念受到了越来越多证据的挑战,这些证据表明,包括神经元在内的终末分化细胞具有类似衰老的特征。
衰老(senescence)是一种局限于增殖细胞的现象,这一概念受到了越来越多证据的挑战,这些证据表明,包括神经元在内的终末分化细胞具有类似衰老的特征。衰老细胞在生命后期的持续存在与组织功能障碍和年龄相关疾病的风险增加有关。
 近日,美国索尔克生物研究所Fred H. Gage和Jerome Mertens研究团队合作在Cell Stem Cell上发表研究,发现阿尔茨海默病(AD)大脑中表达衰老标志物的神经元比例明显较高,并且它们的分布具有旁观者效应(bystander effects)。
近日,美国索尔克生物研究所Fred H. Gage和Jerome Mertens研究团队合作在Cell Stem Cell上发表研究,发现阿尔茨海默病(AD)大脑中表达衰老标志物的神经元比例明显较高,并且它们的分布具有旁观者效应(bystander effects)。
 AD患者的前额叶皮质中
AD患者的前额叶皮质中
衰老神经元的比例增加
CDKN2A基因编码衰老激活蛋白p16INK4a和p14ARF,在衰老细胞中持续上调,被认为是衰老最特异的遗传标记之一。研究人员首先发现,AD患者富含神经元的前额叶皮层(PCx)中CDKN2A mRNA的丰度显著增加[Fig.1A,B]。
由于旁观者效应,衰老细胞倾向于在其驻留的生态位中聚集,通过参照NeuN或DAPI位点计算p16的邻近得分来检查p16的聚集情况,发现p16定位显示出清晰的聚类模式[Fig.1D,E]。
这表明,表达p16INK4a的神经元在AD患者的大脑中更为常见,衰老神经元是分泌旁观者因子的潜在来源,可能是老年人脑衰老细胞簇的起点。
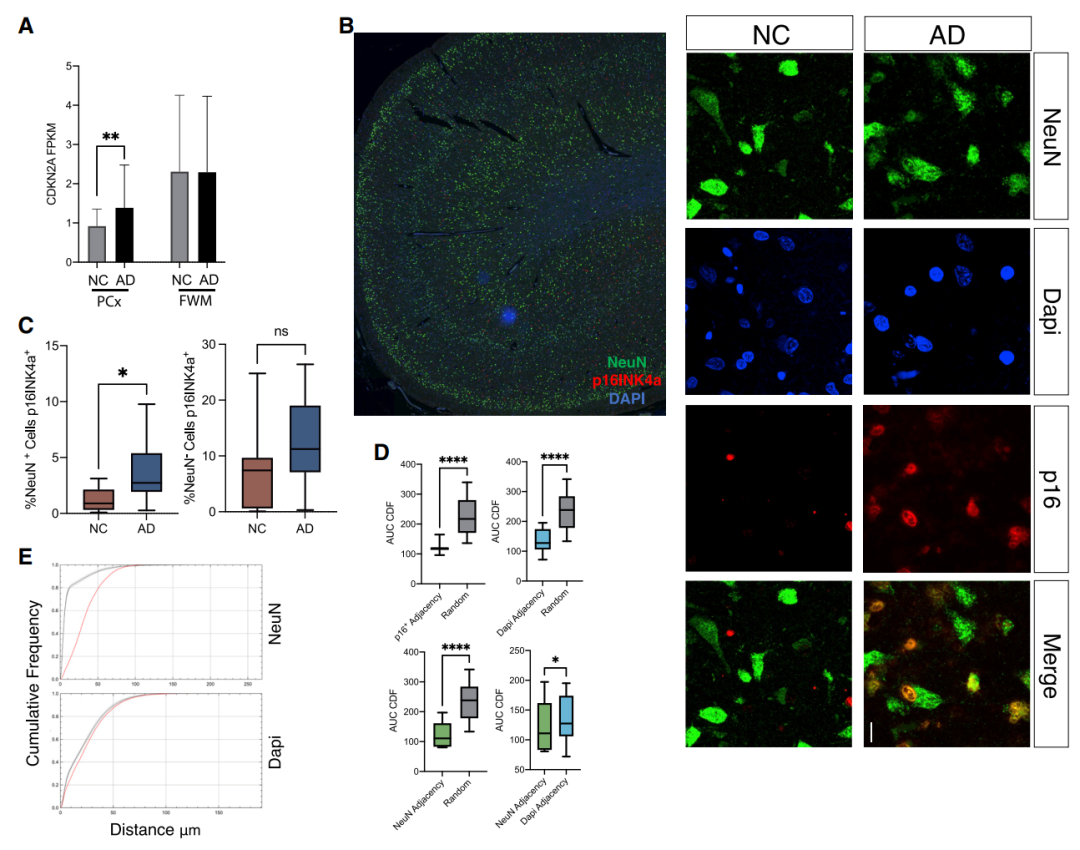
Figure 1 人类AD大脑中衰老神经元的比例增加
年龄等效AD iNs中
衰老转录组和表观基因组模式
接下来检测AD患者中老龄诱导的神经元(iNs)显示出衰老相关特征的程度,研究人员观察到仅在AD iNs中衰老基因的强烈和显著富集,但在再生的AD iPSC iNs、成纤维细胞或iPSC中没有显著富集[Fig.2B,C]。
总之,这些数据表明AD iNs中的表观遗传场景受损,包括衰老基因染色质的松弛、衰老相关组蛋白的上调、衰老启动子甲基化的失调和ETS1转录因子结合,导致AD神经元衰老基因的表达增加[Fig.2]。
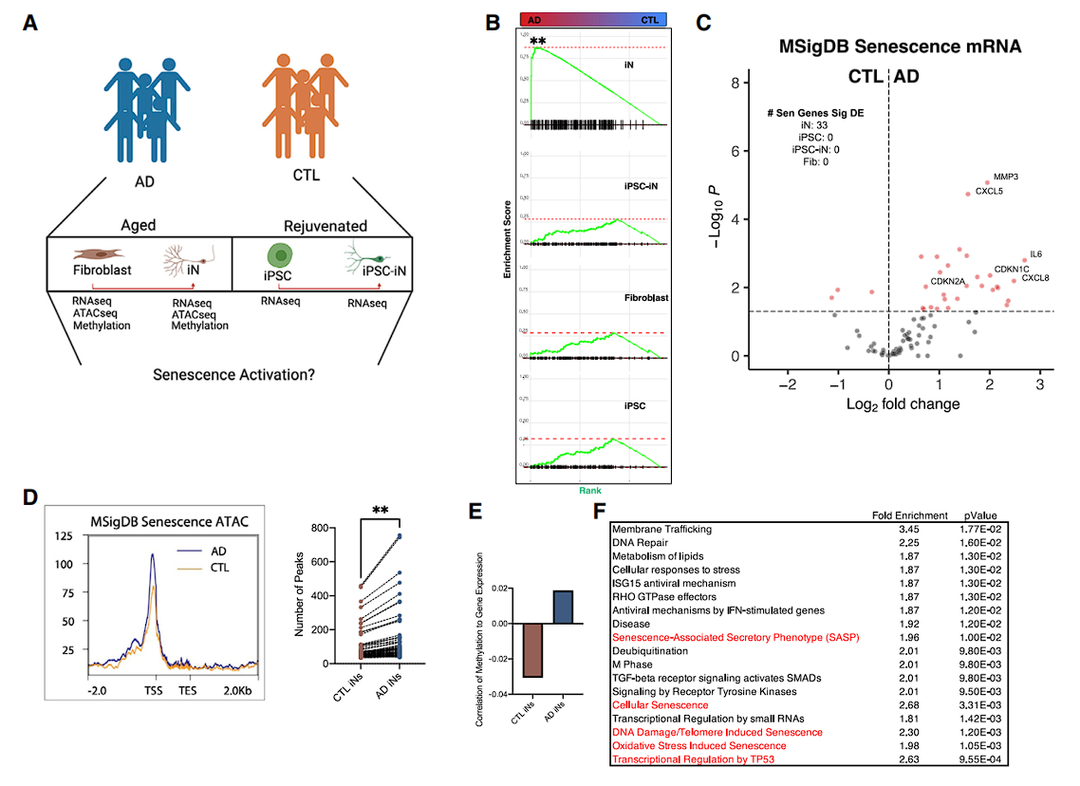
Figure 2 老年AD神经元转录组和表观基因组的衰老变化
AD iNs反映了患者大脑死后
神经元的衰老
并提供了细胞衰老的真正体外标志物
通过蛋白质免疫印迹和免疫细胞化学分析确定iNs能如实地再现AD脑中表达NeuN的细胞中观察到的衰老激活,并且iNs可用于体外模拟自发神经元衰老[Fig.3A,B]。
此外,还测试了常见的衰老标志物衰老相关β-半乳糖苷酶(BGal),发现AD iNs比对照iNs更可能是BGal阳性[Fig.3C]。以及在iPSC iNs中观察到的低水平衰老基因表达表明,衰老激活更可能发生在老年神经元中。

Figure 3 iNs是细胞衰老的真正标志物
单细胞转录组学揭示了
神经元衰老轨迹
为了捕获从正常神经元到衰老神经元轨迹的转录特征,并提取完全衰老神经元的关键特征。通过单细胞测序对非FACS纯化的AD和CTL iN培养物的进行转录组分析。
通过评分和反向图嵌入方法都确定了AD iNs中衰老基因表达的增加,这表明神经元的早期和晚期衰老可以通过最初的代谢和致癌挑战来区分,这些挑战最终导致深度衰老中的促炎反应和代谢重编程[Fig.4]。
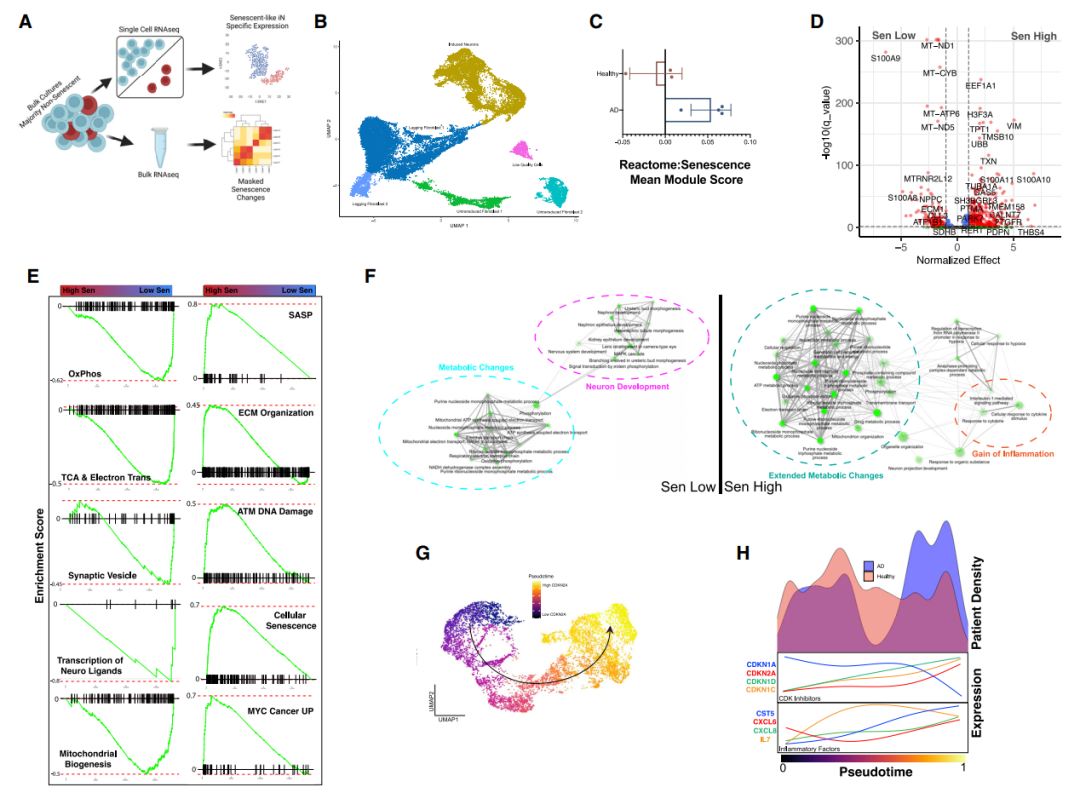
Figure 4 scRNA-seq表明衰老神经元的致癌挑战和代谢功能障碍
致癌基因可引发神经元衰老
并通过衰老细胞疗法消除
最后,通过检测过表达癌基因是否会触发iNs中癌基因诱导的衰老(OIS)。结果发现,与对照组相比,过表达Ras-iNs中p16阳性细胞数量显著增加。重要的是,这种衰老激活并未伴随神经元命运的丧失,Ras或GFP处理组之间NeuN阳性细胞的比例没有差异。
使用衰老靶向药物达沙替尼和槲皮素(D+Q)组合可以特异性地去除衰老神经元,并将AD神经元中的衰老神经元丰度恢复到健康对照组的水平[Fig.5]。

Figure 5 致癌基因可引发神经元衰老,并通过衰老细胞疗法消除
结 论
本文中报告了AD患者大脑中衰老神经元的负担增加,可以使用老龄化的人类神经元培养系统在体外模拟这些细胞,衰老神经元构成了AD患者晚年大脑炎症的神经性来源。即使是一小部分老年衰老神经元的存在,其后果也可能对大脑功能产生深远影响。一个神经元可以通过广泛的突触网络与邻居建立数千个连接,为衰老相关分泌表型(SASP)介导的功能障碍提供了充分的传播机会。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言