NEJM:Inaxaplin治疗两种 APOL1 变异体的蛋白尿肾病(VX19-147-101研究)
2023-03-16 网络 网络 发表于上海
APOL1介导性肾病是一种由APOL慢性肾病是由基因突变引起的。遗传功能增益性肾病(gain of function)APOL由基因突变产生的蛋白质会导致足细胞损伤。这种损伤破坏了正常的肾脏过滤功能,
APOL1介导性肾病是一种由APOL慢性肾病是由基因突变引起的。遗传功能增益性肾病(gain of function)APOL由基因突变产生的蛋白质会导致足细胞损伤。这种损伤破坏了正常的肾脏过滤功能,导致蛋白尿和肾脏疾病的快速进展。进行性肾脏疾病可导致患者需要接受透析和肾移植治疗,并可能导致死亡。局灶性肾小球硬化APOL一种介导性慢性肾病。
Inaxaplin是一款APOL1抑制剂、突破性疗法和突破性疗法PRIME药物鉴定的授予是基于治疗FSGS患者2期临床试验结果。该试验共有16名患者入组,在13名可评估患者中,在标准治疗的基础上联合使用inaxaplin治疗13周后,患者的尿蛋白/肌酐比值(UPCR)获得临床意义和显著的统计降低,平均降低47.6%(95% CI:-60.0%,-31.3%)。此外,在治疗的早期,观察到患者的蛋白尿减少,疗效在整个治疗期间持续13周。无论患者的基线指标或背景治疗如何,都会得到一致的积极结果。
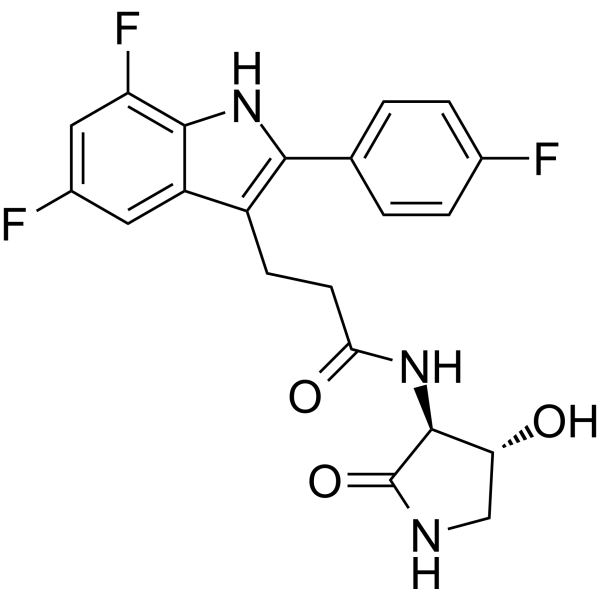
2022年6月,美国FDA已授予在研疗法inaxaplin(VX-147)用于治疗的突破性疗法APOL介导的局灶性肾小球硬化(FSGS)病人。
在编码载脂蛋白 L1 (APOL1) 的基因中具有毒性功能获得性变异的人患快速进展性蛋白尿性肾病的风险更大。 尽管有已知的遗传原因,但缺乏针对具有两种 APOL1 变体(G1 或 G2)的人的蛋白尿肾病的治疗方法。
研究人员进行了一项单组、开放标签的 2a 期临床研究,其中对具有两种 APOL1 变异、经活检证实的局灶性节段性肾小球硬化和蛋白尿(尿蛋白与肌酐比值≥0.7 至 <10 [蛋白质和肌酐均以克为单位测量],估计肾小球滤过率≥每 1.73 平方米体表面积每分钟 27 毫升)。 参与者每天接受伊那沙林治疗 13 周(15 毫克持续 2 周和 45 毫克持续 11 周)以及标准治疗。 主要结果是至少 80% 依从伊那普林治疗的参与者在第 13 周时尿蛋白与肌酐比基线的百分比变化。 还评估了安全性。
该研究仅包括经活检证实的 FSGS 和蛋白尿患者,定义为尿蛋白与肌酐比值 (UPCR) ≥ 0.7 至 < 10(蛋白质和肌酐均以克为单位)。 所有 16 名患者也有两个变体载脂蛋白 L1 (APOL1) 等位基因——G1、G2 或各有一个——而且都是黑人。 参与者来自法国、英国或美国的 12 个地点之一。
在临床前研究中,inaxaplin 在体外选择性抑制 APOL1 通道功能并减少小鼠模型中的蛋白尿。
在临床研究中,16 名参与者参加了 2a 期研究。 在接受依那普林治疗并达到依从性阈值的 13 名参与者中,第 13 周时尿蛋白与肌酐比基线的平均变化为 -47.6%(95%CI,-60.0 至 -31.3)。 在一项包括所有参与者(无论依从性如何)的分析中,除 1 名参与者外,所有参与者均观察到与主要分析中相似的减少,即16 名患者中有 15 名的 UPCR 有所下降。不良事件的严重程度为轻度或中度,均未导致研究中断。
该报告的作者写道,主要结果结果提供了“初步证据”,表明针对两种 APOL1 基因变异 G1 和 G2 导致疾病的机制途径可能是一种有前途的方法,该报告于 3 月 15 日在线发表在NEJM。
尽管这项研究使用 UPCR 减少的替代标记作为肾脏保护的指标,但结果“似乎是一项重大的科学突破,具有巨大的意义,特别是对于非洲血统的患者,”医学博士 Neil R. Powe 在随附的一份报告中评论道。
然而,考虑到该研究的固有局限性,Powe 将其定性为“谨慎的热情”。
除了与 FSGS 的联系外,拥有一对变异的 APOL1 等位基因还与显着增加对其他几种肾脏疾病的易感性有关,包括高血压肾病、HIV 相关肾病、COVID 相关肾病和膜性肾病,以及 如败血症和高血压。
这些肾脏疾病统称为 APOL1 介导的蛋白尿性肾病,一些专家表示“将这些疾病视为 APOL1 肾病谱的一部分而不是单独的疾病状态可能更有用。”
然而,加州大学旧金山分校医学院的 Powe 指出,糖尿病肾病的发展或严重程度似乎与一个人是否拥有 G1 和 G2 APOL1 变体的两个副本完全无关。
“高风险 APOL1 基因型的存在与肾衰竭风险高出 2-100 倍有关,”费城宾夕法尼亚大学教授 Katalin Susztak 医学博士在最近的一篇社论中写道。
但她还指出,携带两个 G1 或 G2 变异体的人终生患肾衰竭的风险“仅为 20% 左右”,这导致专家们假设双变异基因型仅提供第一次打击, 需要未知的第二次打击才能引发疾病发作。
只有一个 G1 或 G2 变体拷贝的人,以及那些有两个野生型 G0 等位基因拷贝的人,没有显示出肾病风险升高的证据。
APOL1 故事的另一个方面是,病理变异的明显遗传起源发生在几千年前生活在亚沙兰非洲的人们身上,他们对非洲锥虫病(也称为非洲昏睡病,由地方性寄生虫引起)具有更强的抵抗力, 吸血采采蝇。
APOL1 基因的 G1 和 G2 变体产生的蛋白质被认为能够杀死寄生虫,这意味着自然选择有利于携带者,与 inaxaplin 研究一起发表的第二篇社论的作者解释道。
根据这些作者的说法,肾足细胞似乎特别容易受到 G1 和 G2 变体的破坏性影响,这会导致足细胞形态、功能和肾脏活力发生大规模变化,并导致多种类型的肾脏疾病,严重程度 蛋白尿。
由于这种对 G1 和 G2 变体的自然选择发生在撒哈拉以南非洲地区,因此如今携带这些有问题的双变体等位基因的人最常见的是非裔美国人或其他黑人。
Inaxaplin 会成为 APOL1 基因分型的理由吗?
APOL1 基因分型不是美国常规实践的一部分,但伊那沙林的早期前景表明,如果进一步的研究证实该药物对于降低具有两种 G1 或 G2 变体的风险是安全有效的,这种情况可能会改变。
“直到现在,还没有理由进行基因分型,因为对此无能为力,”Powe 在接受采访时说。
但现在最终用伊那沙林治疗高危人群的可能性——如果进一步的证据证实其安全性和有效性——开始引发一个问题,即黑人种族作为撒哈拉以南血统的标记是否会成为进行常规 APOL1 基因分型的原因。
Powe 警告说,仅仅发现两个 G1 或 G2 变体并不能保证即将发生肾脏疾病。 然而,伊那沙林的开发“让那些说我们不应该使用种族作为识别人们进行医学检测的方式的人陷入两难境地,”Powe 承认。
Powe 是美国肾脏病学会和国家肾脏基金会组建的一个小组的联合主席,该小组建议在 2021 年将美国的做法转变为不使用基于种族的修饰符的 eGFR 公式。 这两个赞助组织接受并认可了该建议,采用无种族 eGFR 方程式迅速改变了美国的大部分实践。
Powe 说,APOL1 的故事“是一个案例,其中遗传学和种族作为一种社会结构几乎密不可分”,因为高风险基因型与种族密切相关。 “希望医学界能够就如何进行达成共识。现在考虑还为时过早。”
Inaxaplin 目前正在美国、加拿大和欧洲的 100 多个地点进行随机、2/3 期“适应性”研究,计划招募约 470 名患有高危基因型和蛋白尿肾病的患者 疾病。 该研究于 2022 年开始,计划于 2026 年完成。
Inaxaplin 已获得美国食品和药物管理局对 APOL1 介导的 FSGS 的突破性治疗指定,以及欧洲药品管理局对 APOL1 介导的肾病的孤儿药和 PRIME 指定。
inaxaplin 研究由开发该药物的公司 Vertex 赞助。 Powe 没有报告相关的财务关系。 Susztak 报告了与许多公司的财务关系,但没有与 Vertex 建立财务关系。
原始出处:
Inaxaplin for Proteinuric Kidney Disease in Persons with Two APOL1 Variants,N Engl J Med 2023; 388:969-979
DOI: 10.1056/NEJMoa2202396
https://www.medscape.com/viewarticle/989695
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






