Nature Genetics:王艇团队从转座子中发现泛癌症新抗原
2023-03-28 BW “生物世界”公众号 发表于上海
该研究通过开发新的算法,从大数据中深入剖析了TE基因嵌合转录本在33种不同癌症类型的表达,强调了它们作为癌症靶点的可能性,并为免疫疗法及肿瘤疫苗开发提供了大量可针对的潜在靶标。
免疫疗法改变了当前许多不同种类癌症的治疗。它利用了肿瘤特异性表达的新抗原(Neoantigen)来促使免疫细胞以此为目标来高效、特异地攻击癌细胞。
以往研究认为,编码基因的突变是新抗原的主要来源。但最近的研究显示,基因组非编码区域的异常表达,包括转座子(Transposable elements,TEs),也能导致新抗原的产生。转座子占据了人类基因组的近50%。尽管它们在大多数正常成人组织中通常是被抑制的,但在肿瘤中它们可以被转录激活。
近年来的研究表明,在肿瘤中转座子可以成为基因的替代启动子,并产生转座子-基因嵌合转录本。在某些情况下,这些转录本会被翻译成同时具有转座子和基因序列的嵌合蛋白,并具有作为新抗原的潜能。
2023年3月27日,圣路易斯华盛顿大学遗传系王艇教授团队在 Nature Genetics 期刊发表了题为:Pan-Cancer analysis identified tumor-specific antigens derived from transposable elements 的研究论文。
该研究旨在从大量肿瘤及正常组织转录组数据中,全面描述肿瘤特异性转座子-基因嵌合转录本的特征,并评估它们成为33种癌症类型的免疫疗法靶标的潜力。

研究团队首先开发了一个新的算法TEProF2(TE Promoter Finder 2),用于从转录组数据中识别从转座子开始拼接到基因的嵌合转录本(TE-gene chimeric transcripts,TETs)。
然后,研究团队把TEProF2应用到TCGA数据库中的10357个肿瘤和729个病人正常组织样本上,以全面剖析这些转录本在33种癌症类型中的表达。后续通过分析TETs在GTEx中11686个正常组织样本中的表达,筛选出2297个癌细胞特异的TE-基因嵌合转录本(tumor-specific TE-gene chimeric transcripts,TS-TETs)。在TCGA分析的所有10357个肿瘤中,93.6%的肿瘤至少表达了一个TS-TET。此外,其中一些TS-TETs是高度普遍的,例如L1P2_STK31存在于1576个肿瘤样本中。这些转录本中有1068个被预测能编码嵌合蛋白或移码突变蛋白(tumor-specific TE-gene chimeric proteins,TS-TEPs)。因为这些蛋白是肿瘤特定转录本所翻译的,因此它们具有可以作为免疫疗法靶标的极大潜能。
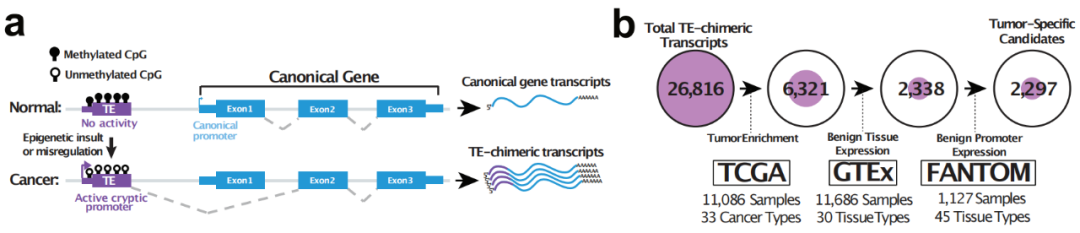
图1:TE-基因嵌合转录本示意图(左); 肿瘤特异性TE-基因嵌合转录本筛选过程示意图(右)
随后,研究团队利用CPTAC提供的肿瘤蛋白质谱数据成功确认TS-TEPs在乳腺癌和卵巢癌肿瘤样本中的存在。此外,他们利用4个细胞系生成HLA-pulldown质谱数据,并从中识别到来自TS-TEPs的抗原。
最后,除了被呈递为抗原来激活免疫反应外,转座子与膜蛋白的嵌合蛋白可以标记在癌细胞外表面,从而作为免疫或靶向疗法针对的对象。作者利用了质谱、商业可购以及定制抗体来评估膜结合TS-TEPs的存在。
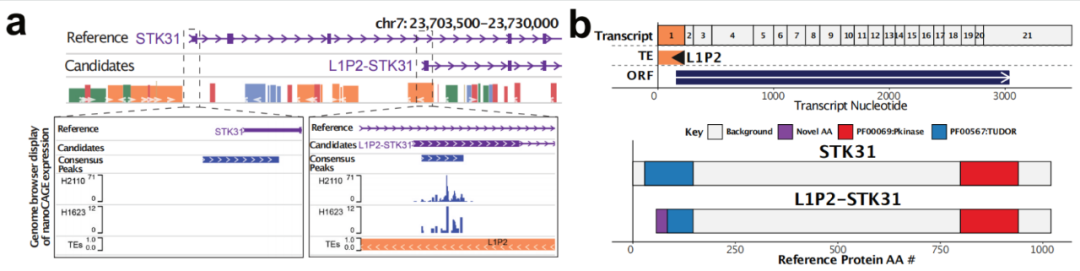
图2:肿瘤特异性TE-基因嵌合转录本L1P2_STK31示意图(左)TE作为基因的替代启动子的转录组学证据(右)L1P2_STK31翻译后的蛋白序列预测
该泛癌症研究发现了数百个多种癌症共享的、来自转座子(TEs)的肿瘤特异性转录本。它们有可能翻译出与HLA分子结合的肿瘤特异性抗原,也可能翻译为膜蛋白成为如CAR-T疗法的靶标。
这些新发现的转录本为设计更普适的癌症生物标志物和创新治疗方法方面提供了宝贵的资源。仅仅20个TS-TEPs的组合便可以帮助我们识别或靶向所分析的10357个肿瘤样本中的67.4%。这意味着现成、普遍适用的癌症疫苗在不久的未来会成为可能,也为临床癌症治疗开辟了新的思路。TS-TETs和TS-TEPs广泛扩大了现有癌症治疗疗法的候选标靶。
这项研究也存在一些不足。虽然TS-TEPs作为免疫疗法的目标很有前景,但该研究尚未证明它们在病人样本中的免疫原性。此外,此研究没有对其他来自非编码序列的抗原进行分析,这些抗原可能是除TS-TEPs之外有价值的共享抗原。最后,此研究表明,在识别来自转座子尤其是重复序列的抗原时,必须进行严格的过滤,以帮助减少脱靶效应。
综上所述,该研究通过开发新的算法,从大数据中深入剖析了TE基因嵌合转录本在33种不同癌症类型的表达,强调了它们作为癌症靶点的可能性,并为免疫疗法及肿瘤疫苗开发提供了大量可针对的潜在靶标。
王艇课题组的Nakul Shah、张孝贤和梁永浩为论文共同第一作者。王艇教授是美国圣路易斯华盛顿大学遗传系Sanford and Karen Loewentheil Distinguished Professor of Medicine,同时也是计算机科学与工程的教授,兼任McDonnell Genome Institute的科研主任。王艇教授长期领导大型国际项目例如ENCODE,Roadmap,4DN,TaRGET以及当前最新的人类泛基因组计划(Human Pangenome Project)和IGVF(Impact of Genetics Variation on Function),Funding多多。团队目前正在招聘博士后,欢迎联系(http://wang.wustl.edu/)。
原始出处:
Shah, N.M., Jang, H.J., Liang, Y. et al. Pan-cancer analysis identifies tumor-specific antigens derived from transposable elements. Nat Genet (2023). https://doi.org/10.1038/s41588-023-01349-3.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言