EMBO Molecular Medicine:ASO药物,促进冷休克蛋白表达,预防朊病毒病、痴呆症等神经退行性病变
2023-03-26 王聪 “生物世界”公众号 发表于上海
是否可以利用冷休克蛋白来治疗患者,而不需要冷却身体,为急性脑损伤提供更安全的治疗方法,或保护大脑免受痴呆症、朊病毒病的侵害?
当身体明显降温时,一种名为RBM3的冷休克蛋白(Cold Shock Protein,CSP)水平会增加,这种现象首次在冬眠动物身上观察到。研究认为,在冬眠期间,这种蛋白质有助于保护大脑免受损伤并允许大脑继续形成新的连接。
早在2015年,剑桥大学的 Giovanna Mallucci 教授团队在小鼠实验中发现,RBM3可以保护大脑免受与错误折叠蛋白质堆积相关的损伤,大脑中的错误折叠蛋白质堆积可能各种形式的痴呆症,包括阿尔茨海默病(AD)、帕金森病(PD),以及克雅氏病(CJD)等朊病毒疾病。
诱导低温疗法已经被用于治疗重症监护病人,包括新生儿和创伤性脑损伤患者,患者被置于昏迷状态,让他们的大脑处于“冷却”状态以防止损伤。但这种治疗方式也会带来相关的风险,例如凝血和肺炎。
我们是否可以利用冷休克蛋白来治疗患者,而不需要冷却身体,为急性脑损伤提供更安全的治疗方法,或保护大脑免受痴呆症、朊病毒病的侵害?
近日,柏林自由大学和剑桥大学的研究人员在 EMBO Molecular Medicine 期刊发表了题为:ASO targeting RBM3 temperature-controlled poison exon splicing prevents neurodegeneration in vivo 的研究论文。
这一发现是利用大脑冷却的保护作用来治疗急性脑损伤患者,甚至预防阿尔茨海默氏症等痴呆症的一步。
剑桥和柏林的科学家使用一种基因疗法来提高老鼠大脑中所谓的“冷休克蛋白”的水平,保护它们免受朊病毒疾病潜在的毁灭性影响。

在这项研究中,剑桥大学和柏林自由大学的的科学家们研究了一种被称为反义寡核苷酸(ASO)的基因疗法是否能增加小鼠大脑中冷休克蛋白的水平,从而保护它们的大脑。
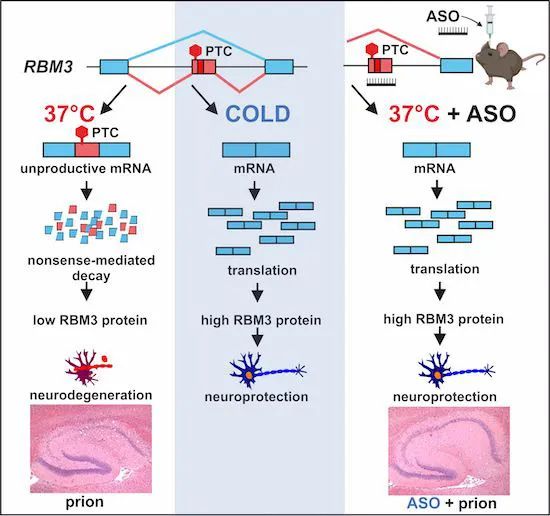
研究团队检查了编码产生冷休克蛋白的RBM3基因,发现RBM3基因的内含子3中含有一个进化上保守的热诱导毒性外显子——E3a,在正常温度条件下(37℃),该毒性外显子中含有的提前终止密码子抑制了RBM3基因的表达,而在低于37℃的低温诱导下,RBM3基因的mRNA的剪接会跳过该毒性外显子,表达出RBM3蛋白。删除该毒性外显子,或使用ASO跳过该毒性外显子,可以长期促进RBM3蛋白表达。
为了测试这种方法是否能保护大脑,研究团队使用朊病毒感染小鼠大脑。然后让其中一组感染了朊病毒的小鼠在三周后注射单剂ASO治疗,另一组小鼠则作为对照组。
在朊病毒感染12周后,对照组小鼠患上了朊病毒病,表现出海马体神经元的大量损失,而海马体是大脑中对记忆很重要的区域。
而接受ASO治疗的小鼠的情况则大不相同,这些小鼠的RBM3蛋白表达水平是对照组小鼠的两倍。接受ASO治疗的8只小鼠中,有7只在海马体中显示出广泛的神经元保存。
论文共同通讯作者、剑桥大学的 Giovanna Mallucci 教授表示,从本质上讲,冷休克蛋白使大脑能够保护自己,在这种情况下,防止朊病毒病对大脑神经细胞的损害。值得注意的是,这项证明,只需注射一次ASO就足以提供持久保护作用,防止神经退行性变原本的不可避免的进展。
论文共同通讯作者、柏林自由大学的 Florian Heyd 教授补充道,这种方法提供了能够预防阿尔茨海默病和帕金森病等疾病的前景,对于这些疾病,目前还没有可靠的预防治疗方法。这项在小鼠身上的研究距离人体应用还有很长的路要走,但如果我们可以安全地使用ASO来促进人类冷休克蛋白的表达,就可能预防痴呆症。我们已经看到了ASO被成功应用于脊髓性肌萎缩症(SMA)的治疗,治疗渐冻症(ALS)的ASO药物也将于近期获批。
如果这些发现可以在人类身上复制,那么这种通过ASO来促进冷休克蛋白RBM3表达的方法可能会对神经退行性疾病及以外的患者的治疗产生重大影响,包括新生儿心脏手术时缺氧造成的急性脑损伤,中风,以及成年人头部损伤。
原始出处:
Marco Preuner, et al. ASO targeting RBM3 temperature-controlled poison exon splicing prevents neurodegeneration in vivo. EMBO Mol Med (2023)e17157.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










认真学习了
31