这篇来自59分Nautre子刊的重磅综述为你揭秘6mA的前世今生!
2022-08-09 酒酿丸子 解螺旋
为了确认 6mA 在多细胞真核生物中的存在及其对应的生物学功能,我们需要严格地评估现有的数据、设计未来的研究方案和开发新的方法。
6mA及其修饰机制与潜在功能
N6 -甲基腺苷(N6-methyladenosine, 6mA)是表观遗传修饰中的一种。过去,人们认为6mA 修饰只存在于原核生物和原生生物的基因组中。然而,随着技术的发展,对于多细胞真核生物中是否存在 6mA、以及6mA是否是定向的表观遗传修饰的问题,目前存在较大的争议。2022年3月波士顿儿童医院的Konstantinos Boulias教授与Eric Lieberman Greer 教授联合在Nature Reviews Genetics(IF=59.581)上发表了题为《Means, mechanisms and consequences of adenine methylation in DNA》,系统性地分析多细胞真核生物中是否存在 6mA、及其修饰机制与潜在功能的证据。
为了最大程度帮助大家吸收与理解,本人在阅读综述的时候,也给大家翻译了遍,希望能给大家带来有真正价值的“学术营养”。

摘要
从单细胞原生动物、藻类到多细胞植物、哺乳动物,N 6 -甲基-2'-脱氧腺苷(N6-methyl-2′-deoxyadenosine, 6mA) 已在原核生物和真核生物的 DNA 中被广泛报告。6mA涉及的功能包括调节 DNA 结构和转录、跨代传递信息、在疾病中发挥作用等。然而,它是否在最近演化的真核生物(除原生生物外的真核生物,如陆地植物、蠕虫、昆虫、两栖动物、鸟类、啮齿动物和灵长类动物等)中存在仍然有争议。6mA 的修饰很稀少,尽管技术的发展大大促进了对 6mA 的识别和定量,但是每种识别和定量 6mA 的技术都存在局限性。因此,为了确认 6mA 在多细胞真核生物中的存在及其对应的生物学功能,我们需要严格地评估现有的数据、设计未来的研究方案和开发新的方法。
引言
定向 DNA 表观遗传修饰包括N4 -甲基胞嘧啶 (N4-methylcytosine,4mC)、C5 -甲基胞嘧啶 (C5-methylcytosine, 5mC)、N6 -甲基腺苷(N6-methyladenosine, 6mA 或m6dA) (图1a)。其中,4mC主要在嗜热细菌和古细菌的基因组中被发现;5mC 是在最近演化的真核生物基因组中最主要的和被最广泛研究的 DNA 修饰;6mA 易与RNA N6 -甲基腺苷( RNA N6-methyladenosine, m6A)混淆,其中后者是mRNA腺苷酸(A)第六位N位置的甲基化修饰。m6A修饰发生在大约25% 的哺乳动物 mRNA 中,并且在这些转录本中平均发生1 到 3 次。
通过改变核苷的化学性质,包括对结合蛋白的亲和力和被修饰底物自身的稳定性,基因组 DNA (gDNA) 的修饰可以调节核酸的功能。例如,5mC 修饰能提高 DNA 螺旋的稳定性,主要起到抑制基因表达的作用;而6mA会使螺旋不稳定,导致 DNA 解旋,即起到稳定碱基对并破坏碱基堆积的作用。
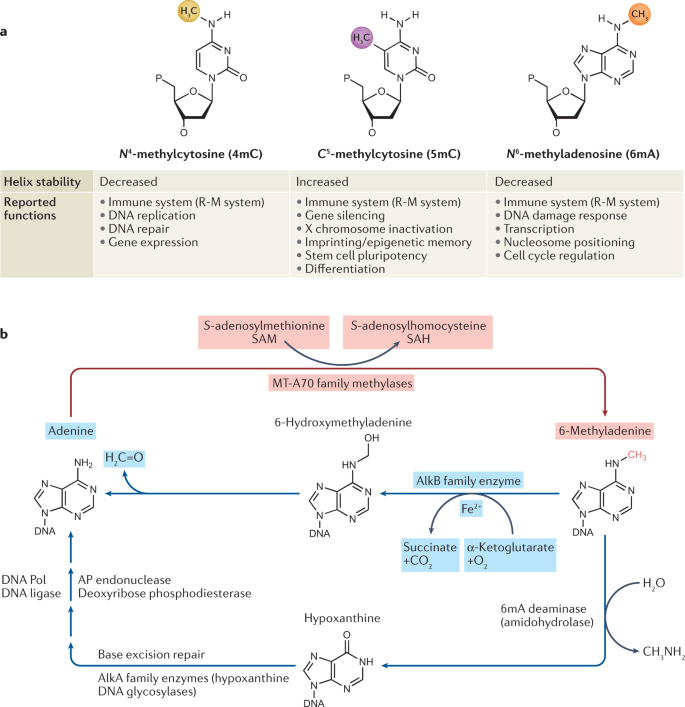
图1:定向表观遗传 DNA 甲基化
在原核生物和原生生物中,特异的DNA 腺嘌呤甲基转移酶(DNA adenine methyltransferases)以S-腺苷甲硫氨酸(SAM 或 AdoMet)为主要的甲基供体,以5,10-亚甲基四氢叶酸为次要甲基供体,将6mA修饰到DNA上。至于去除6mA修饰则可以通过以下的两种方式,一是通过AlkB家族的Fe(II)和α-酮戊二酸依赖性双加氧酶去除,二是通过6mA脱氨酶转化为次黄嘌呤,然后通过AlkA家族的次黄嘌呤DNA糖基化酶进行碱基切除修复(图1b)。6mA 修饰涉及的功能包括原核免疫、DNA 损伤反应、转录调节、核小体定位和细胞周期控制等。
过去,人们认为6mA 修饰只存在于原核生物和原生生物的基因组中,然而,目前有研究发现,6mA 也存在于多细胞真核生物的 gDNA 中,如藻类、植物、无脊椎动物和脊椎动物。这些发现在很大程度上是由过去十多年开发出来更灵敏的新 6mA 检测技术推动的。与所有技术一样,在解释检测出的结果时也需要考虑上述技术的局限性。因此该领域的一些研究者提出疑问,多细胞真核基因组中发现的 6mA修饰是真正的 DNA 修饰还是技术误差?也有其他研究者疑问,如果真的存在 6mA修饰,那么该过程是否与细菌的定向修饰机制类似,还是通过其他的细胞过程?gDNA 甲基化也可能是非酶促 DNA 损伤性病变(如 1mA)的 Dimroth 重排,或者是 DNA 聚合酶掺入预甲基化 RNA 或 DNA 核苷(如通过核苷酸补救途径产生)的结果 (图 2)。
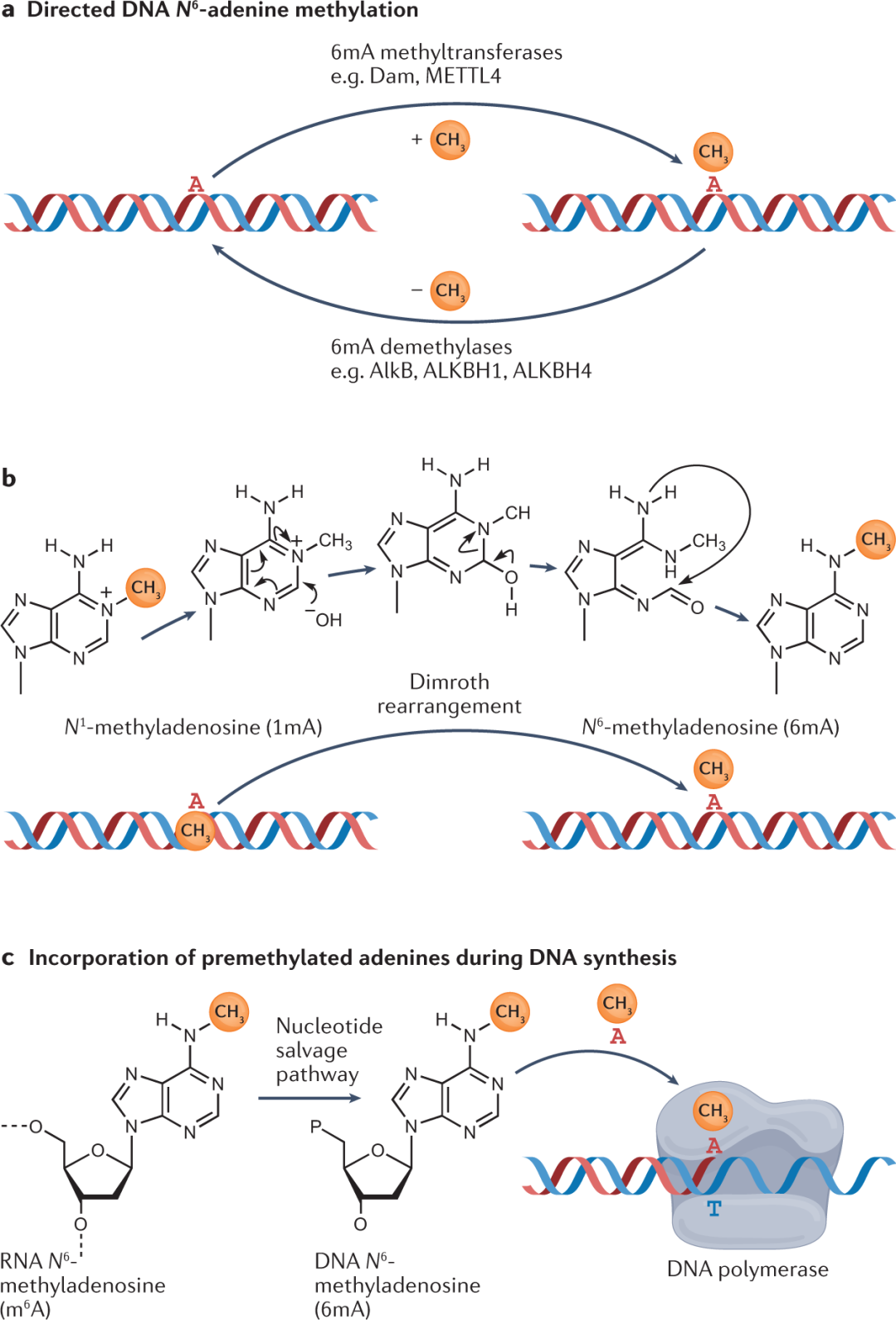
图2:6mA 富集的潜在模式
在本综述中,我们总结并分析了多细胞真核生物是否存在 6mA 修饰、以及6mA是否是定向的表观遗传修饰的证据。我们首先整理了检测6mA的方法以及被认为是在多细胞真核生物中增添、去除和识别 6mA 修饰的酶,其次讨论了 6mA 在原核生物和原生生物中的功能是否可能在后生动物中被保留,以及归纳了 6mA 参与多细胞真核生物的其他生物过程的证据,包括应激反应、疾病和非遗传信息的代际传递等。
讨论
1检测基因组6mA 的方法
在过去的十多年里检测与定量6mA 的方法发展迅速。但因为每种检测与定量6mA 的技术都有各自的局限性,所以有必要同时使用多种互不相干的技术(orthogonal approaches)来彼此验证,以确认或排除 6mA 的存在。在本节中,我们批判性地评估了用于识别、定量和定位 6mA 的技术,并探讨在不同研究中这些技术产生差异结果的原因。
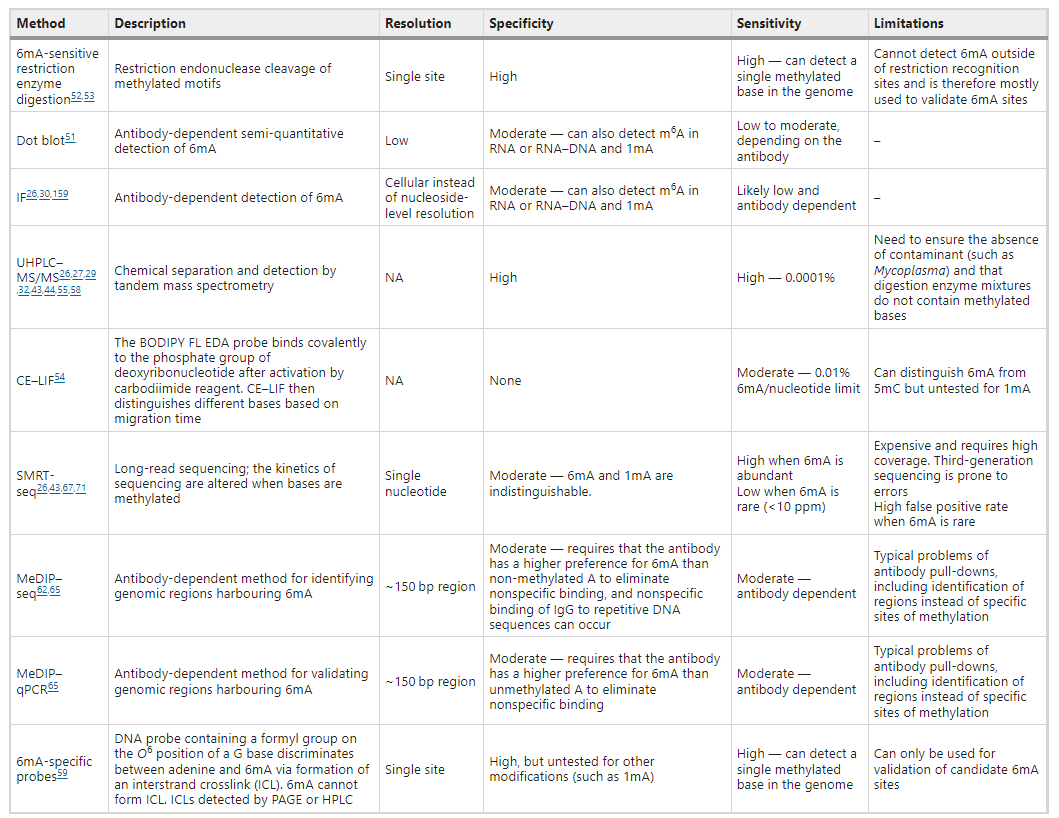
表1:检测基因组 DNA 中腺嘌呤甲基化的技术
检测和定量 6mA 的技术
过去,在DNA 甲基化中6mA 的检测和定量技术包括盐结晶、纸层析、紫外吸收光谱、斑点印迹和电泳迁移率技术,这些技术是相对不灵敏的。尽管对甲基化敏感的限制酶(restriction enzymes)的运用提高了检测的灵敏度(即可以检测出单个甲基化碱基),但是这种技术只能检测到限制酶识别的基序内的甲基化碱基(也就是会忽略其他的甲基化信息)。
现在,毛细管电泳和激光诱导荧光技术 (capillary electrophoresis and laser-induced fluorescence,CE-LIF) 可以检测出核苷酸中占比低至0.01%的6mA。液相色谱法(Liquid chromatography)也越来越灵敏。超高效液相色谱法与串联质谱法 (UHPLC-MS/MS) 的结合能够检测出核苷酸中占比低至 0.00001% 的 6mA。UHPLC-MS/MS因其特异性和灵敏度,已成为验证任何生物中6mA的存在并量化6mA 的主要方法。
然而,和大多数其他 6mA 定量技术一样,UHPLC-MS/MS的主要缺点在于无法区分给定 gDNA 样品中 6mA 的来源。潜在的6mA 污染物包括微生物群或其他物种的 DNA ,或者用于消化 UHPLC-MS/MS 的 DNA 的酶(从细菌中纯化)等。在与潜在污染物的丰度相比, 6mA 在目标生物体中的丰度非常低的情况下,使用UHPLC-MS/MS检测 gDNA 样品中的 6mA 是一个非常棘手的问题。因此,当 6mA 丰度较低时,研究人员必须使用不依赖于相同试剂的多种不相干技术确认其存在,并确定显著改变 6mA 的水平和/或分布的环境或遗传条件,进而确认它是目标生物体中的一种积极调控修饰。
定位 6mA 的技术
除了开发出量化基因组中 6mA 水平的技术外,目前研究人员还开发出了几种技术用于定位6mA在基因组中的位置。对6mA的定位有利于描述其与基因表达、DNA 损伤修复、细胞周期调节和核小体定位和染色质调节之间的相关性。甲基化 DNA 免疫沉淀 (Methylated DNA immunoprecipitation,MeDIP) 使用特异性抗体来吸附并沉淀甲基化的gDNA。MeDIP与定量 PCR (MeDIP-qPCR) 的结合可以用来确定特定残基的甲基化水平。其操作步骤主要分为两步,首先是使用在特定序列区域中与甲基化/未甲基化腺嘌呤结合的探针或者是使甲基化DNA带有放射性,接着是限制性消化、电泳与测序。
MeDIP 与微阵列分析或 DNA 测序技术 (MeDIP-seq ) 的结合可以用于定位全基因组的甲基化位点。这种检测方法采用高度特异性的 6mA 抗体,其中最常用的 6mA 抗体对甲基化腺嘌呤的亲和力是未甲基化腺嘌呤的 1,000 倍以上。然而,在大多数多细胞真核生物基因组中,每百万腺嘌呤里只有一或二个腺嘌呤被甲基化,此时会导致相对大量的非特异性结合和下拉( pull-down)。除此之外,抗体对未修饰的重复 DNA 序列也具有一定的内在亲和力。因此,需避免文库制备过程中的过度扩增,进而最大程度地减少重复序列造成的干扰作用。MeDIP-seq与光交联(photo-crosslinking)、核酸外切酶和限制性内切酶的结合可以提供接近单核苷酸的分辨率,不过这种技术仅用于检测特定基序内的甲基化腺嘌呤。
最后,长读长测序技术可以直接定位 DNA 中的甲基化碱基,如单分子实时测序 ( single-molecule real-time sequencing,SMRT-seq) 和牛津纳米孔测序(Oxford nanopore sequencing)。SMRT-seq 提供了一种与通过特异性抗体检测甲基化位点完全不同的方法。根据不同的DNA修饰在测序过程中由于互补碱基掺入率的变化会产生独特的动力学特征,这种技术可以在单核苷分辨率下检测每种不同的 DNA 修饰。当6mA在碱基中以低于百万分之十( ppm)存在时,就需要高测序深度,此时定位会失去一定的准确性。在细菌中, 6mA 在特定基序中以高丰度出现。在多细胞真核基因组中,早期的一些SMRT-seq 分析是基于为细菌设计的映射算法。为了排除检测到的甲基化碱基是假阳性的,研究人员需要更高的测序深度来重复这些分析。SMRT-seq 和 MeDIP-seq 针对相同 gDNA 样本生成的数据之间往往缺乏可重复性,这说明了定位 6mA 的困难。
后生动物中报告的 6mA 位置和水平的差异
针对含有丰富 6mA 的原核基因组,研究人员对SMRT-seq和 UHPLC-MS/MS等技术进行了开发和优化。然而,对于 6mA 的丰度要低几个数量级的多细胞真核基因组来说,这些技术就不太准确,需要进一步地优化。除此之外,UHPLC-MS/MS 技术能检测出样品中的所有 6mA,无论它们是什么来源,因此该技术对含有大量 6mA 的污染物(如原核生物 DNA)很敏感。这些技术上的不准确性和局限性,可能会导致后生动物基因组中报告的 6mA 浓度范围很广。例如在哺乳动物中,不同的研究得出了截然相反的结论——6mA 要么根本不存在,要么在人类胶质母细胞瘤来源的干细胞中以低至 0.1-1 ppm 和高达 ~1,000 ppm 的水平出现。
在大多数多细胞真核基因组中,也存在类似具有差异性的报道。最近的一项研究试图通过开发一种基于 SMRT-seq(称为 6mASCOPE)的定量检测 6mA的方法来解决这些差异,该方法对存在污染物的目标样品的 6mA 进行去卷积。将 6mASCOPE 应用于黑腹果蝇、拟南芥和智人样品中,研究人员检测到在生物体中的 6mA 含量较低(~2-3 ppm);而来自蝇肠道微生物组或植物土壤的污染细菌来源的 DNA 中则发现了较高的 6mA。
另有研究提出,当 6mA 抗体拉下 DNA 的特定区域或酶始终定位于基因组的特定区域时, 也可能检测到的是RNA:DNA 杂合体中的m6A 修饰。尽管如此,检测到的 6mA 水平范围仍有可能反映真实的生物变异,例如细胞类型、发育阶段或环境背景之间的差异。这些情形下, 6mA 的基础水平可能低到无法检测,而更高的6mA水平可能反映了与环境相关的变化,因此,当未能检测到 6mA 时,可能是因为在错误的生物环境中观察细胞。在研究中比较差异时,重要的是要考虑生物学因素,例如细胞类型和培养条件。因此,为了确保检测到的甲基化腺嘌呤具有生物学相关性,最好实施添加、去除或识别 6mA 所需酶的基因操作和/或改变 6mA 水平的环境操作。

表 2:拟在真核生物中调节或合成 6mA 修饰的酶
在不同技术与不同物种间,研究人员报告了 6mA 定位的不一致。物种间定位的差异可能反映了真正的生物学差异,例如, 6mA 在小鼠的 X 染色体上富集。然而, 6mA在人类 SMRT-seq 样本和秀丽隐杆线虫的 X 染色体上缺失。相比之下,在哺乳动物和黑腹果蝇中,LINE- 1 (young long interspersed nuclear element 1)反转录转座子元件的6mA富集并不能总是检测出。与此一致的是,当应用不同的测序技术或绘制不同的细胞系时,会报告不一致的 6mA 定位。尽管这些不一致可能反映了 6mA 是针对特定基因组区域而不是特定位点,但是它们也可能是由于二级结构或 RNA 污染导致的技术问题。因此,我们需要效果更优良的6mA定位技术,进而探讨 6mA 定位与其他表型之间的相关性。
2真核6mA的生物学相关性
真核生物中是否存在6mA 修饰是一个有争议的话题,一方面检测出的含量极少,另一方面有局限性的检测方法本身也容易造成假阳性。在真核基因组中存在少量的活性DNA N6-甲基转移酶、去甲基化酶和 6mA 互作因子,这些证据支持6mA 作为表观遗传修饰物是具有生物学相关性的。然而,这些蛋白的存在并不能明确证明 6mA 在真核生物中是起到真正的调节修饰作用。因为6mA可能在真核生物中拥有了新的功能或作用于新的底物。即使在真核生物中保留了修饰 6mA 的能力,这种功能在生理条件下可能也无关紧要。因此,在本节中,我们将讨论在公认的多细胞真核生物中的6mA 调节酶和 6mA 相互作用蛋白,以及它们是否为6mA 作为定向的DNA 修饰提供了足够的支持证据。
在多细胞真核生物中公认的N 6 -腺苷甲基转移酶
在后生动物中寻找N6 -腺苷甲基转移酶的关键是寻找含有 MT-A70 结构域的蛋白质,该结构域是从 M.MunI样细菌的 6mA DNA 甲基转移酶进化而来的。这种结构域同源方法将秀丽隐杆线虫中的 DAMT-1 蛋白鉴定为N6 -腺苷甲基转移酶(表 2)。METTL4 是 DAMT-1 的哺乳动物同源物,也被认为是一种N6 -腺苷甲基转移酶。METTL4可以修饰 gDNA ,并且已经被证明在体外对哺乳动物线粒体 DNA (mtDNA) 具有活性,这提高了 6mA是真核生物中定向的表观遗传修饰的可能性。
然而,在体外( in vitro)和离体(ex vivo)实验的基础上,也有研究提出 METTL4 催化 snRNA上的 m6Am 。因此,对于所有公认的 DNA 甲基转移酶,进行动力学实验以确认其对 DNA 的特异性或者对替代底物的偏好性与生理功能有关是很重要的(表 2)。事实上,研究还提出了这样的一种酶N6AMT1 ——起初基于同源性被认为是 N6 -腺苷甲基转移酶,后来在人类的体外和离体实验中,表明它更有可能是一种 eRF1的谷氨酰胺甲基转移酶。晶体结构也显示 N6AMT1 的活性位点和底物结合位点带有负电荷,因此N6AMT1可能无法与 DNA 结合。同时,N6AMT1 和细菌 DNA 甲基转移酶对 DNA 和 eRF1 的体外活性的比较显示,N6AMT1 在生理条件下仅对 eRF1 有活性。
有趣的是,人类 RNA m6A 甲基转移酶复合物 METTL3-METTL14 已被证明对单链 DNA 具有体外活性。然而,这种 RNA 甲基转移酶复合物对 DNA是否具有生理相关活性尚不清楚。这些公认的甲基转移酶的例子,强调了确认公认的N6 -腺苷甲基转移酶活性与生理功能相关的重要性。
多细胞真核生物中公认的N6 -腺苷脱甲基酶
从细菌到人类,AlkB 家族的DNA 和/或 RNA 去甲基化酶都是保守的。AlkB 去甲基化酶使用氧气氧化 6mA 的甲基,产生不稳定的中间体 6-羟甲基腺嘌呤 (6hmA),然后自发释放甲醛并再生未修饰的腺嘌呤碱基(图 1b)。人体中有 9 种 AlkB 蛋白( ALKBH1-8和 FTO),其中 ALKBH4 和ALKBH1已被报告可以使6mA去甲基化 (表2 )。ALKBH4 在体外去甲基化测定中可以使 6mA 去甲基化 ,其在秀丽隐杆线虫的同源物 NMAD-1 中也被认为是 DNA 6mA 去甲基化酶。在体外,ALKBH1 具有使单链 DNA 去甲基化的能力,并且在小鼠胚胎干细胞中,ALKBH1 基因的敲除会导致全局 6mA 水平的增加。
对小鼠和人类 ALKBH1 结构的研究表明,比起双链或单链甲基化 DNA,ALKBH1 更喜欢部分打开或起泡(bubbled)的 DNA 作为底物。此外,最近还有研究人员在大鼠组织和人类细胞系中检测到了 6hmA,并证明了 ALKBH1 在体外( in vitro)和离体(ex vivo)的情况下都可以产生 6hmA ,这表明 6mA 去甲基化的机制是保守的。然而,ALKBH1 与各种潜在底物的体外试验表明,ALKBH1优先使 tRNA 上的 m1A 去甲基化,而另一项体外研究则表明ALKBH1是使 tRNA 上的 m5C去甲基化。
令人惊讶的是,TET 蛋白在后生动物中能使 5mC 去甲基化的,而在黑腹果蝇(一种似乎缺乏 5mC 的生物体)中能使 6mA去甲基化。此外,与野生型果蝇的提取物相比,缺乏Dmad活性的果蝇的细胞核提取物(编码 TET 同源物的黑腹果蝇基因)表现出在体外去甲基化活性降低,并且通过补充纯化的 DMAD 蛋白后细胞核提取物恢复了活性(表 2)。尽管 TET 家族成员应该不会使细菌中的嘌呤去甲基化,并且几个物种的晶体结构也表明 TET 催化结构域应该不能容纳嘌呤的翻转,但是它们仍有可能在特定情况下开发出额外的功能,例如在没有标准底物时(就像上述的黑腹果蝇中的情况)。
6mA 结合蛋白的存在支持 6mA 的功能作用
6mA 调节生物功能的机制之一是通过识别、招募或拮抗效应分子产生的(表 2)。例如,在细菌中,MutH蛋白 和 SeqA 蛋白可以与半甲基化DNA的 6mA 结合,两者分别起到维持 DNA 复制的保真度与调节复制时间的作用。原核生物中最普遍和最明确的 6mA 结合蛋白是限制性内切酶。在 6mA 特异性的限制酶中,保守的腺嘌呤甲基化酶相关(RAMA)结构域也在真核蛋白质中得到鉴定。此外,研究人员还鉴定出了SeqA 结构域、HARE-HTH 结构域和 ASCH 结构域。根据这些结构域的特征,它们也被预测能与N6 -腺嘌呤甲基化 DNA结合。在真核蛋白质中这些结构域的存在,使人们相信 6mA 可能在多细胞真核生物中存在并且发挥真正的作用。
在真核生物中,除了已经发现具有预测的 6mA 结合域的蛋白质外,研究还发现了几种在体外被 6mA 直接或间接地调节与DNA 结合的蛋白质。通过荧光各向异性(fluorescence anisotropy)评估、人类细胞的Pull-down实验和定量质谱分析,线粒体蛋白 SSBP1 被鉴定为 6mA 结合蛋白。SSBP1对甲基化 DNA 的结合亲和力比对未甲基化 DNA 的结合亲和力增强约 2.5 倍(表 2)。线粒体转录因子 TFAM 对未甲基化 DNA 具有轻微的结合偏好,并且 6mA修饰的增添能抑制mtDNA 的体外转录,这体现了 6mA 在哺乳动物 mtDNA 中的功能。
体外结合实验表明,6mA 拮抗哺乳动物转录因子和染色质调节剂(regulator) SATB1 与其潜在结合位点的结合,这种相互作用可以解释:在滋养层干细胞分化过程中, 6mA 是如何防止常染色质扩散到异染色质区域的(表 2)。然而,当 6mA 直接位于胸腺嘧啶前方时,它会导致 DNA 螺旋的剧烈弯曲,这可能会阻止 SATB1的结合。至于6mA是否是主动排斥与SATB1的结合,或者体外合成的寡核苷酸是否没有足够的空间与任何转录因子结合仍有待确定。
研究表明,在黑腹果蝇中,与未甲基化 DNA 相比,叉头转录因子 Jumu 在体外更倾向于与 6mA 甲基化 DNA 结合,并且体内 Jumu 结合位点( 由 ChIP–seq确定 )和 6mA 定位(由MeDIP–seq确定)有显著的重叠(表 2)。黑腹果蝇的 6mA 区域富含合子基因组激活(zygotic genome activation,ZGA)所需的必需基因,这与Jumu 在结合和激活参与涉及胚胎基因组激活(maternal-to-zygotic transition)的甲基化靶基因的转录过程中的作用一致。相比之下,WER是在拟南芥中对发育至关重要的转录因子 ,其与胞嘧啶的C 5位或腺嘌呤的N 6位甲基化的基序结合较少(表 2)。
总之,这些例子表明了 6mA 在促进或抑制与效应蛋白的结合方面具有潜在的作用,这些效应蛋白是能将公认的表观遗传信息转化为生物学功能的。
在多细胞真核生物中间接掺入 6mA 的证据
尽管上述研究表明 6mA 可能是在后生动物中定向甲基化事件,但是也有研究表明它是 DNA 聚合酶错误掺入回收的甲基化核苷酸的结果(图 2)。已有研究提出,向哺乳动物细胞施用外源预甲基化的 DNA N6 -甲基腺嘌呤和 RNA N6 -甲基腺苷,会导致这些化合物被掺入到哺乳动物 的DNA 。然而,甲基化核苷酸的错误掺入并不能排除定向甲基化的作用,并且这些研究没有检测可能揭示定向 6mA 的特定环境条件下的 mtDNA 甲基化水平等。此外,如果是在体内将预甲基化腺嘌呤掺入多细胞真核生物的 gDNA 中,这也不能否认这些“错误掺入”的碱基在功能上不重要。因此,检测在不同条件下6mA 的变化水平是有必要的。如果能在特定位置提高6mA的水平,即使是通过间接机制,那它仍然可能具有重要的生物学功能。
3.6mA的生物学作用
原核生物和原生生物(例如莱茵衣藻、嗜热四膜虫和变藓棘毛虫 )具有公认的6mA生物学作用, 因此对6mA的研究最好在上述生物中进行。作者在本节讨论了这些生物学作用,并探讨来自多细胞真核生物的新证据是否支持多细胞真核生物在进化过程中保持这些6mA 功能。
修饰限制系统
尽管真核生物已经进化出复杂的免疫系统,但是原核生物仍使用 DNA 甲基化作为标记系统来区分自身 DNA 和外源 DNA。细菌已经开发出独特的的核酸内切酶,可以根据自身基因组的甲基化状态选择性地切割外来噬菌体 DNA。如果细菌将自身的 DNA 甲基化,那么限制性内切酶将选择性地切割未甲基化的 DNA。相反,如果细菌自身的 DNA 非甲基化,那么限制性内切酶将选择性地切割甲基化的 DNA(图3a )。有趣的是,黑腹果蝇和哺乳动物的 LINE-1 反转录转座子中的 6mA 与转座子抑制相关(图 3a )。即使已整合到宿主基因组中,6mA 在识别和抑制外源 DNA 方面也可能具有保守作用。然而,因为 LINE-1 中的 6mA 富集不总能被检测到,所以这一潜在作用还需要进一步证明。
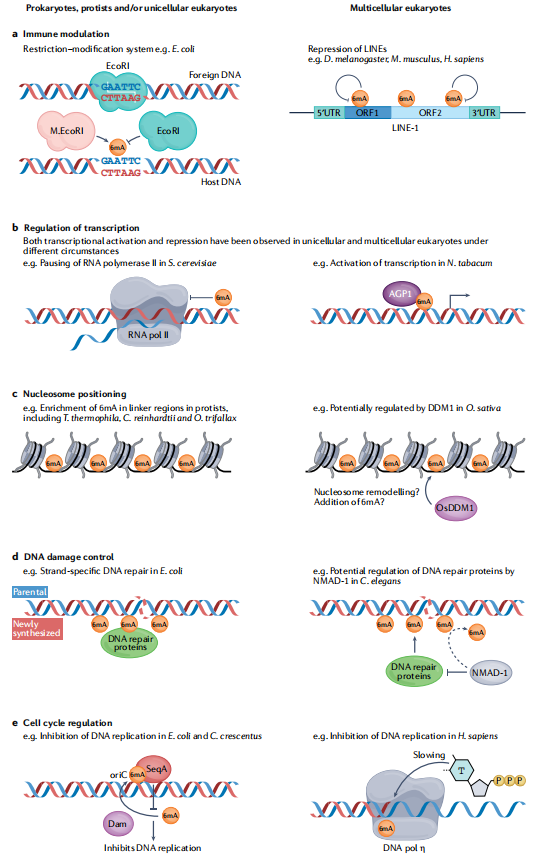
图 3:在单细胞和多细胞生物中可能保守的 DNA 腺嘌呤甲基化的生物学作用
对转录的影响
在细菌中,除了作为限制性修饰系统发挥免疫功能外,6mA 还直接调节宿主基因的表达,这些基因的功能涉及细菌毒力和防御噬菌体感染等。在单细胞真核生物莱茵衣藻中,6mA 与基因的活跃转录相关;在几种不同的真菌物种中,6mA以簇状出现在表达基因的转录起始位点附近;在拟南芥、水稻、大麦、烟草、小麦、斑马鱼中,6mA 还与被6mA修饰的基因的转录增加以及电穿孔到小鼠体内的甲基化载体的转录增加相关。
然而,在寄生虫阴道毛滴虫中,6mA 与被6mA修饰的基因的表达下调有关;在黑腹果蝇中,6mA与被6mA修饰的基因表达的上调和下调均有关。这些依赖于物种和组织的影响可能是由于 DNA 甲基化造成的:当DNA 结构的松弛时,有利于增加基因的表达;当募集 6mA 特异性结合蛋白时,可以激活或抑制基因的转录。
研究表明,6mA 可以直接影响特定转录因子的结合亲和力(图 3b ),其对特定基因转录的影响可能取决于基因调控序列和相关转录因子。然而,使用酿酒酵母 RNA 聚合酶 II 进行的体外转录延伸实验表明,6mA 降低了尿苷的掺入效率并导致聚合酶工作停止(图 3b),这表明如何克服这种物理停顿将决定转录活性是否增加。为了进一步探讨 6mA 修饰与基因表达的相关性,研究人员未来需要实施更多的定向甲基化实验,以探索 6mA 修饰是否是转录变化的原因。
核小体定位
在嗜热四膜虫(etrahymena thermophila)、莱茵衣藻(C. reinhardtii )和史氏链球菌(O. trifallax)中,6mA 优先定位于核小体之间的连接区域(图3c ), 这种修饰可能有助于指导核小体定位。在莱茵衣藻中,6mA 与基因表达上调相关,这可能是常染色质 DNA 增加、螺旋稳定性降低和转录机制的募集共同作用的结果。在体外,6mA 对史氏链球菌DNA的核小体占位(nucleosome occupancy)很重要。
然而,体内实验表明,在缺乏 MTA1 基因(编码N 6 -腺嘌呤甲基转移酶)的史氏链球菌的基因组中,核小体占位情况没有显著变化,转录起始位点附近的甲基化基因的转录情况也没有发生显著变化。这表明在没有 6mA 修饰的情况下,其他因素也可以在一定程度上恢复核小体占位。研究提出,DDM1(Deficient in DNA methylation 1) 在拟南芥和水稻中控制体内 C5 胞嘧啶甲基化,并且在拟南芥中还能移动核小体,这与 DNA 的 5mC 状态无关。有趣的是,6mA 富集于水稻DNA的连接区域,DDM1 的缺失会导致水稻基因组中 6mA 减少 2.5 倍。这说明 DDM1 对 6mA 甲基化和核小体重塑可能都很重要(图 3c)。6mA 积累与核小体重塑之间是否存在机制或功能联系仍有待确定。
DNA损伤控制
在大肠杆菌(Escherichia coli)和真菌产黄青霉(fungus Penicillium chrysogenum)中,缺乏 DNA 腺嘌呤甲基转移酶功能的突变体具有更高的突变率,并且突变体对 DNA 损伤剂更敏感。这表明6mA可以防止 DNA 损伤或影响 DNA 修复过程。事实上,在大肠杆菌和其他革兰氏阴性细菌中,研究人员通过标记亲本DNA 链,发现了6mA 可以帮助维持 DNA 复制后的保真度。同时,在错配的情况下,大肠杆菌和其他革兰氏阴性细菌可以募集 6mA 结合蛋白以特异性切割错配链并合成新链(图 3d)。这种 DNA 错配修复方法主要在细菌中存在,而在真核生物中存在不同的机制。然而,最近有研究提出,秀丽隐杆线虫基因 nmad-1(编码 6mA DNA 去甲基化酶)的突变会导致 DNA 修复基因表达的缺陷,进而使 DNA 损伤水平升高,这表明6mA在原核DNA修复功能中的某些方面可以在真核生物中得到保留(图3d)。
细胞周期调控
缺乏功能性 6mA 甲基转移酶 Dam 的大肠杆菌突变体无法正确调节 DNA 复制的时间。在野生型大肠杆菌中,DNA 甲基结合蛋白 SeqA 在复制起点 OriC 处与 6mA 的结合,推迟 DNA 复制,直到细胞分裂(图 3e)。相反,在没有 SeqA 结合的情况下,6mA 会降低热熔解温度并促进 DNA 在起始点处展开,促进DNA 复制。另一种革兰氏阴性菌,即新月茎杆菌,也以类似的方式调节DNA的复制与细胞周期的进程。在 PaP1(一种感染铜绿假单胞菌的噬菌体)的基因组中, 6mA修饰水平的增加,会显著降低了 DNA 聚合酶 Gp90 exo -的效率,这表明 DNA 聚合酶可能直接受到甲基化腺嘌呤的影响。
一些初步证据暗示 6mA 可能在调节真核生物的细胞周期中发挥作用。例如,在秀丽隐杆线虫中,公认的 6mA DNA 去甲基化酶编码基因 nmad-1 的突变会导致生育力下降,这是染色体分离缺陷伴随着 DNA 复制延迟和 DNA 修复受损造成的。此外,最近有研究将人类 SSBP1(一种 mtDNA 复制因子)鉴定为 6mA 结合蛋白,这说明6mA 也可能在调节 mtDNA 复制中发挥作用。
最后,在体外动力学实验中,研究发现,6mA 降低了人 DNA 聚合酶-η (DNA polymerase-η)的复制效率,这表明如果 6mA 存在于人体中,它可以抑制 DNA 的复制(图 3e )。为了明确 6mA 在多细胞真核生物细胞周期调控中的作用,研究人员需要通过多种独立的技术手段来寻找在复制起点处差异富集的6mA区域,并且在复制起点处进行定向 N6-腺嘌呤甲基化或去甲基化实验,进而评估6mA对细胞周期进程的影响。在真核生物中,6mA调节后生动物细胞周期的机制可能是直接调节细胞周期基因的表达,而不是像在细菌中那样通过标记复制起点的方式。
4.6mA 的新兴角色
尽管对6mA 是否存在于多细胞真核生物有一定争议,但是近年来有一些关于真核生物6mA的潜在特异性功能被提出。作者在下文批判性地评估了 6mA 在多细胞真核生物的生物过程中发挥作用的证据,并讨论了这些研究的优势和局限性。
对压力的反应
目前有几项研究表明,6mA 可能对高等真核生物的压力(stress)具有响应和调节作用。经 HPLC-MS/MS 和 6mA 免疫沉淀、 qPCR 评估后,暴露于炎热环境的水稻在关键热应激基因处显示出 6mA水平显著增加。通过斑点印迹分析,秀丽隐杆线虫经抗霉素(电子传递链抑制剂)处理后会导致 6mA 水平总体提高。通过 UHPLC-MS/MS 和 MeDIP-seq 评估,缺氧诱导人类细胞系会导致 mtDNA 中 6mA水平提高(图 4a)。经点印迹和 LC-MS/MS 评估,慢性压力或恐惧消退学习会使小鼠中大脑总体 6mA 水平的提高。然而,当检测水平提高的6mA(由 MeDIP-seq )与其对应的基因水平(由 RNA-seq)的相关性时,有两项研究得出的结论是相反的,这表明 6mA 在小鼠大脑中发挥激活性修饰功能还是抑制性修饰功能取决于基因的上下文环境。
有趣的是,压力也有可能导致 RNA m6A 水平的提高和 RNA 稳定性的降低,这反过来又可能导致预甲基化的 RNA 核苷通过核苷酸补救途径更多地掺入 gDNA。这种错误掺入修饰核苷的情况对 DNA 的甲基化影响较小,但同样重要。这也有助于解释对压力反应的基因表达水平出现相反的情况。
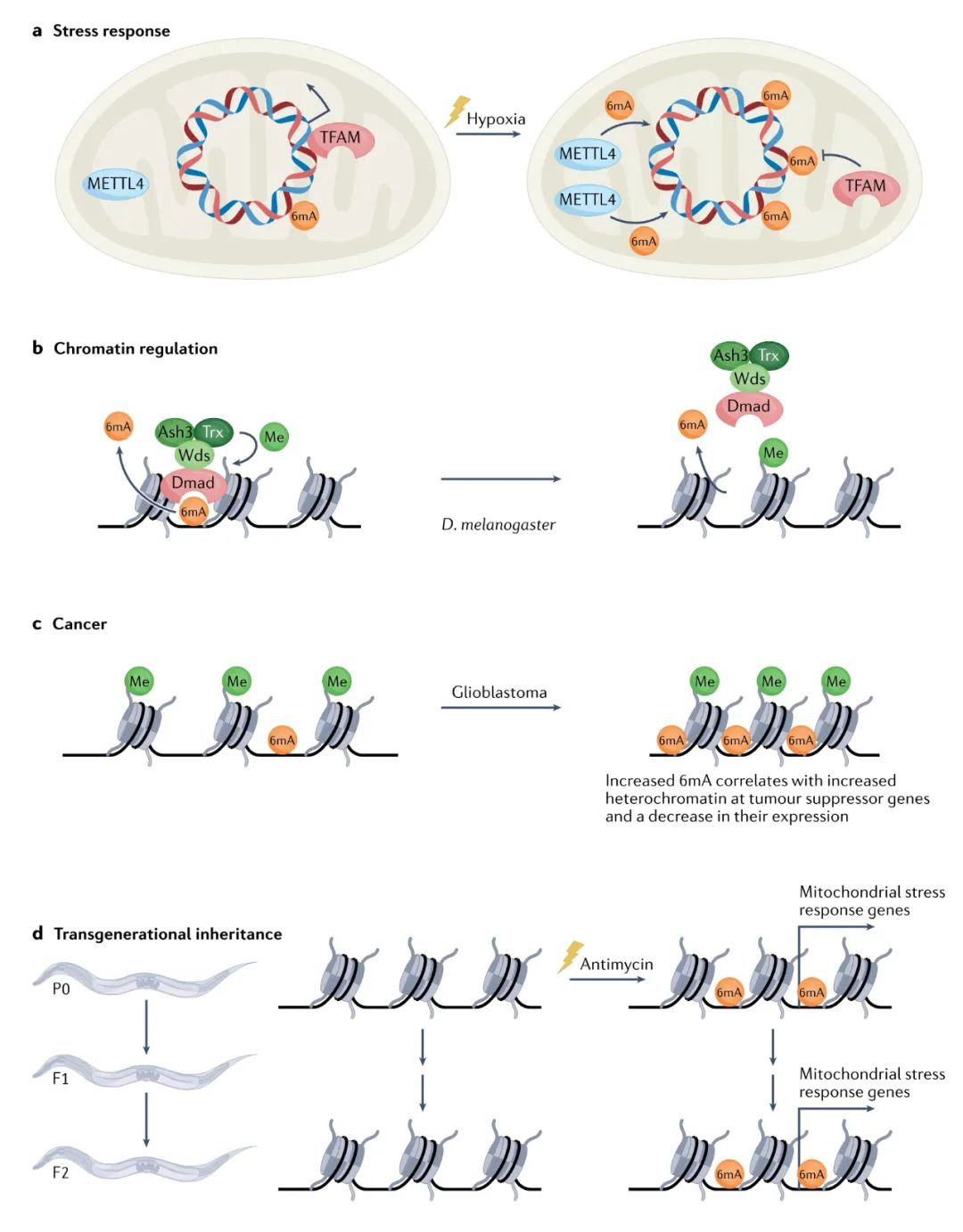
图 4:6mA 在后生动物中的新兴潜在作用
染色质调控
6mA 已被证实在后生动物基因表达中发挥调节作用。它可能是通过直接影响染色质的折叠和转录因子的募集,也有可能是通过与其他表观遗传修饰进行通信,进而发挥募集其他染色质调节酶的作用。例如,5mC 已被证明对指导组蛋白甲基化很重要,反之亦然,因为负责这些表观遗传修饰的修饰酶也可以与其他表观遗传修饰之间发生相互作用。6mA 与染色质边界、组蛋白变体 H2A.X29 和各种组蛋白修饰(包括H3K4me2、H3K9me3 和 H3K27me3)相关,进而可以推测这些修饰可能通过与 6mA 通信以加强表观遗传修饰作用。
在秀丽隐杆线虫中,研究人员通过操纵 6mA 调节酶和组蛋白 H3K4 甲基转移酶的表达,在遗传上位性实验(genetic epistasis experiments)中揭示了表型间的协调调节作用。在黑腹果蝇中, DNA 去甲基化酶 Dmad 显示与 Wds 结合,其中Wds 是三甲基化 H3K4 复合物的组成成分。研究发现,在功能丧失的 Dmad 突变体中H3K4me3 的表达水平降低(图 4b)。
此外,研究还发现 6mA 修饰位点(由 MeDIP-seq 测定)和多梳蛋白结合位点(polycomb proteins)(由 ChIP-chip 测定)之间存在显著重叠,其中多梳蛋白催化与转录抑制相关的组蛋白 H3K27me2/me3。在黑腹果蝇中, 6mA与转录抑制有关,即这些染色质修饰之间的相互作用会加强抑制的染色质状态。类似地,在小鼠中,通过操纵6mA 甲基转移酶基因Mettl4和 6mA 去甲基化酶基因Alkbh4,研究人员证实了 6mA 结合蛋白和 polycomb 募集之间具有协调相互作用。在 6mA 与转录增加存在相关性的生物体中,6mA 是否是通过与激活组蛋白修饰酶进行通信进而发挥作用的仍有待确定。
癌症
斑点印迹分析表明,人类三阴性乳腺癌组织样本的 6mA 总水平低于正常乳腺组织样本。然而,经由斑点印迹、UHPLC-MS/MS 和免疫荧光检测,在胶质母细胞瘤干细胞系和原代样品中检测到的 6mA 水平高于星形胶质细胞,并且在胶质瘤细胞系中,6mA 与异染色质相关的表观遗传修饰水平的提高相关 。在神经胶质瘤细胞系中,敲除公认的 6mA 去甲基化酶基因ALKBH1会导致 6mA 和基因表达水平提高,进而抑制肿瘤细胞增殖并增加植入神经胶质瘤ALKBH1的小鼠(免疫功能低下)的存活率(图4c)。总之,这些数据说明 6mA 可能有助于调节人类特定癌症亚型生长的。
跨代继承
由于 DNA 复制的半保守性,6mA 信息可以轻松地通过细胞分裂得到保留,并跨代传递。标记实验(Labelling experiments)表明,大肠杆菌中新合成的 DNA能很快被N 6 -腺嘌呤甲基化。这可能是在标记特定的残基,并且这种信号可以在新产生的细胞中传递与迅速增强。在秀丽隐杆线虫中,经抗霉素(电子传递链中复合物 III 的抑制剂)的处理,在缺乏功能性 H3K4 去甲基化酶的突变动物中6mA 水平显示跨代提高(图 4d)。
重要的是, 6mA 甲基转移酶基因damt-1的缺失会丢失上述两种情况下的跨代表观遗传表型,这体现了 DAMT-1 酶在将非遗传信息(non-genetic information,指不涉及遗传等位基因的机制从祖先那里获得的性状)从祖先传递给后代方面中的重要性。尽管 6mA 采用半保守的方式遗传,并以类似于 5mC 的遗传方式重新应用于新合成的链,但是与 5mC 不同,6mA 似乎不会标记 DNA 的互补链。
因此,如果6mA参与表观遗传,它更有可能通过与其他染色质修饰或非编码 RNA 的协调通信的方式在新细胞和新一代中重新获得。然而,目前尚不清楚 6mA 是否确实存在于秀丽隐杆线虫的基因组中。因此需要使用与 6mA 甲基转移酶融合的nuclease-null Cas9 进行定向的表观遗传修饰,以证明定向6mA甲基化是表观遗传信息跨代传递的原因。
未来展望
尽管目前关于 6mA 存在于高等真核生物基因组中并发挥调节作用是有说服力的,但是并不确凿(表 3)。因此未来相关的实验设计需采纳多种不相干技术,以确认(或排除)6mA作为定向表观遗传修饰的存在。如果存在,则需确定它涉及哪些生物过程。


表 3 调查真核生物中 6mA 水平和/或分布的研究总结
确认 6mA 是多细胞真核生物的定向修饰
如果 6mA 是一种定向修饰,那么在不同研究的相同实验条件下,研究人员将会在给定细胞或组织类型的相同基因组位置中检测出 6mA。反之,如果是通过核苷酸补救途径从 RNA 或外源 DNA 掺入预甲基化碱基的,那么研究人员将会检测出 更随机的6mA分布。尽管人类 gDNA 的 SMRT 测序揭示了 6mA 分布的一致性,但是未来仍需要独立的 6mA 检测技术验证这一结论。此外,还需要排除其他解释,如测序错误可能会给人一种局部的、受调控修饰的错误印象,就像在复制压力下的脆性位点(fragile sites)通过 DNA 聚合酶非定向掺入预甲基化 6mA 一样。
为了进一步提高定位6mA 的准确性,基于6mA 的独特化学性质,研究人员可以采用新型的不依赖于抗体的测序方法,即类似于 5mC 的亚硫酸氢盐测序。一种可能的方法是使用对非甲基化腺嘌呤或N 6 -甲基化腺嘌呤有明显偏好的腺嘌呤脱氨酶, 将所有未甲基化的腺嘌呤或所有 6mA 转化为肌苷。肌苷能与胞嘧啶碱基配对,而甲基能发生特异性脱氨基作用。经 PCR 扩增后,所有的甲基化腺嘌呤能转化为鸟嘌呤,进而通过测序分析读出碱基变化。这种方法能避免由于后生动物 DNA 中 6mA 的低丰度导致的假阳性问题,并确保甲基化碱基包含在感兴趣物种的 gDNA 中。
然而,与所有新方法一样,为确保检测到的碱基经作用脱氨的频率是明显高于自发脱氨的预期频率的,这种技术必须进一步的测试。另一种很有前景的新 6mA 测序技术是亚硝酸盐测序技术。这种技术是在酸性条件下使用亚硝酸钠选择性地对未甲基化的腺嘌呤脱氨基。N 6 -甲基化腺嘌呤不受亚硝酸盐处理的影响,而未甲基化的腺嘌呤则被选择性地脱氨基为次黄嘌呤。经聚合酶链反应和测序后,次黄嘌呤被读作鸟嘌呤。然而,为了确保在多细胞真核生物中存在的低浓度下也准确检测 6mA,该技术仍需经彻底测试来确定检测的阈值。
在响应环境因素或生物过程时,一致的 6mA 浓度变化也将支持 6mA 的调节作用。几份研究表明,6mA 在发育过程中会改变其浓度。成年黑腹果蝇基因组的纳米孔测序表明,6mA 在发育基因中更为普遍,并且6mA与这些发育基因的表达呈正相关。然而,在另外两项研究中,黑腹果蝇大脑和卵巢的 MeDIP-seq 分析显示, 6mA 与基因抑制相关。假设其所使用的技术是特异性检测 6mA的,这些结果表明 6mA 在调节黑腹果蝇基因表达中具有组织特异性的作用。
UHPLC-MS/MS 和免疫荧光分析表明,6mA 在斑马鱼、小鼠和猪的配子和早期胚胎的早期细胞分裂过程中积累,并且斑点印迹和 SMRT-seq 显示,在拟南芥发育过程中,全部植物提取物里6mA均动态增加。未来仍需要进一步确认在多细胞真核生物中甲基化的这些变化,不是由于微生物群或基因组中普遍存在 6mA 的外来细菌造成的。使用不依赖抗体的测序方法来定位 6mA 的变化,并结合基因实验来揭示公认的 6mA 调节酶对 6mA 水平的影响,将有助于确定6mA是否对调节发育很重要。
为确认 6mA 为定向 DNA 修饰,研究人员需要对负责添加和去除 6mA 的酶进行全面表征。考虑到 DNA 和 RNA 甲基转移酶和去甲基化酶属于同一酶家族的情况,6mA 甲基化酶和去甲基化酶的体外和体内表征应包括动力学实验,以确保在生理条件下酶仍具有活性并发挥功能。由于线粒体具有古老的起源, 所以 6mA 调节酶发挥作用的亚细胞部位最可能是线粒体。最近的两份研究使用多种不相干技术发现,mtDNA 中的 6mA 水平比人类细胞系中的人类 gDNA中的 6mA 水平高约 100 到 1,000 倍, 并且在缺氧条件下,该水平差距会进一步增加。
有研究表明 ,在线粒体中METTL4 的存在是 mtDNA 发生 6mA修饰的必要条件。敲除 METTL4 会导致 mtDNA 基因表达的增加以及 mtDNA 拷贝数的增加,这表明线粒体上的 6mA 会抑制转录和 mtDNA 复制(图 4a)。这一发现还提出了一种可能性,即在特定条件下检测到的 6mA 浓度变化可能是由于细胞中线粒体数量和/或含 6mA 的 mtDNA 数量的变化。在评估 6mA 水平时需要考虑这一因素,因为它可能也解释了不同组间的定量差异,以及不同mtDNA 提取方法的效率差异。
生物学功能确认
如上所述,使用不依赖于抗体的测序技术来确认 6mA是一种真正的定向修饰,确认6mA 响应环境变化或生物条件的一致变化,以及对公认的 6mA 调节酶的验证,将促进对6mA 功能的研究。例如,对N 6 -腺嘌呤甲基转移酶和去甲基化酶的验证将能够评估对其基因操作后的生物学后果。此外,基因组中 6mA 的准确定位将有助于有针对性的对其进行表观基因组编辑实验。将无核酸酶的 Cas9 与 DNA 甲基转移酶或去甲基化酶融合,并将表观基因组编辑器引导至特定位置以改变特定基因的 6mA 状态,可以确定N 6 -腺嘌呤甲基化对基因表达的影响以及由此产生的功能后果。为确保基因表达的变化是 6mA 状态变化的结果,而不是融合蛋白结合的结果,研究人员还需要将一种催化失活的酶融合到无核酸酶的 Cas9 上进行验证。
结论
尽管真核生物中6mA相关研究再次兴起,并且更灵敏和更精确的定位技术也已经出现,但是也有一些研究报告了检测这种修饰碱基的困难,特别是在多细胞真核生物的基因组中。因此,在解释研究结果时必须十分谨慎。该研究领域倾向于探讨在多细胞真核生物中是否存在 6mA。我们认为,目前大量的证据表明,在多细胞真核生物中, 6mA 含量比一些初期报告所揭示的要少得多。此外,6mA如果真的存在,那么可能仅在特殊情况下才能达到始终可检测的水平,例如响应缺氧或在ETC 压力情况下。这可能有助于解释其他相似样本中存在不一致的结果。
由于6mA在多细胞真核生物中可能是非常低的丰度,所以作者希望,这一领域日益完善的技术与更严谨的证明标准能够支持 6mA 在多细胞真核生物中的功能作用。如果多种不相干的技术可以相互验证多细胞真核生物 DNA 中 6mA 的存在及其动力学,识别和确认 6mA 甲基转移酶和去甲基化酶的体内活性和特异性,并证明特定甲基化事件的直接功能后果,那么证明6mA在多细胞真核生物中发挥重要的生物学作用的证据的可靠性会更强。
各位小伙伴们还想看什么类型的综述,欢迎留言!
—END—
撰文丨酒酿丸子
排版丨吱吱
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#重磅#
34