体液细胞形态与流式结合协助诊断浆母细胞淋巴瘤一例
2023-06-09 林晓燕,陆婧媛 厦门大学附属中山医院 “检验医学”公众号 发表于上海
对于PBL这类罕见的淋巴组织肿瘤,除MICM外,往往需要综合临床和影像学检查才能确诊;所以,检验、病理、影像和内外科的多学科合作尤为重要,良好的检验与临床沟通往往为患者的诊断和治疗赢得时间。
前言
非霍奇金淋巴瘤是较霍奇金淋巴瘤更常见的一大类淋巴系统恶性增殖性疾病,其原发病灶可在淋巴结,也可在淋巴结外的淋巴组织。浆母细胞淋巴瘤(PBL),是一种临床罕见的侵袭性B淋巴细胞淋巴瘤,肿瘤细胞呈类似免疫母细胞的大B淋巴细胞弥漫性增殖并表达浆细胞相关抗原,而缺乏成熟B细胞标记,因PBL多见于免疫功能缺陷的患者,2016年WHO将其归为人类免疫功能缺陷相关淋巴瘤。
案例经过
患者,女,64岁,因“活动后气喘2周”就诊我院呼吸内科,肺部CT提示双侧胸腔积液。胸腔积液呈渗出性改变,白细胞数显着升高且以单个核细胞为主,病理活检考虑淋巴组织增生性疾病,不除外浆细胞肿瘤及B细胞淋巴瘤。全身PET-CT提示右侧卵巢癌伴多发转移可能性大,建议左侧锁骨上淋巴结活检明确。
因影像与病理活检结果存在差异,而患者拒绝采取深部组织送病理活检,加之血清卵巢肿瘤标志物也明显升高,临床诊断一度陷入僵局。在送检胸水常规细胞形态学检查和流式细胞免疫表型分析均明显提示存在浆细胞肿瘤可能的情况下,检验与临床主动沟通,促成临床明确诊断方向,最终取得患者深部组织做病理活检并确诊浆母细胞淋巴瘤。
临床案例分析
患者因胸腔积液和PET-CT提示右侧卵巢癌伴多发转移可能性大先后两次入住我院呼吸内科和妇产科。胸水肿瘤标志物检测:CA125:827.60U/mL。乳酸脱氢酶1036U/L,血清钙正常。盆腔磁共振(见下图):子宫左侧及上方、双侧腰大肌、髂腰肌异常信号灶,考虑恶性肿瘤,肠管来源,淋巴瘤可能。双侧髂血管周围多发肿大淋巴结,盆腔积液。宫颈多发纳氏囊肿可能。前腹部软组织肿胀。
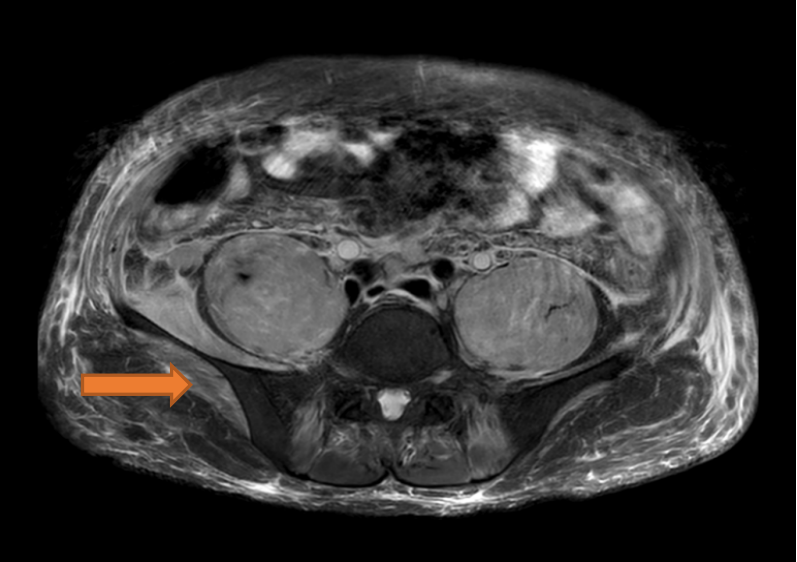
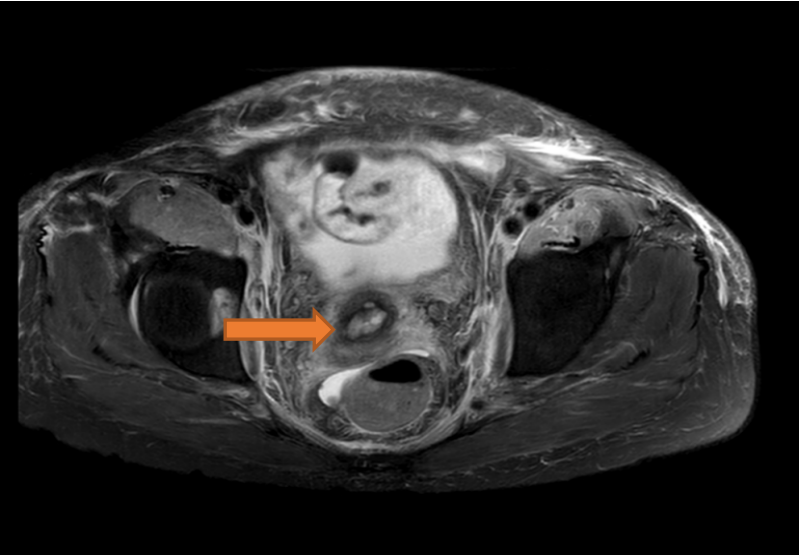
肺部CT:双侧胸腔积液,双肺部分不张,双肺感染,心包少量积液。左锁骨上区、纵膈、右心膈角多发小淋巴结。
胸水细胞学检查发现原始浆细胞样的异常细胞,胸水流式细胞免疫表型分析提示异常浆细胞约94.1%,CD45阴性或弱表达,CD38+,CD56+,CD19部分弱表达,单克隆表达胞浆Kappa,提示浆细胞肿瘤可能。
深部组织病理活检结果提示浆细胞肿瘤,免疫组化提示CD138+,CD38+,CD56+,而CD20、CD79a等成熟B细胞标志缺失,免疫固定电泳阴性,骨髓未见浆细胞异常,PET-CT上主要为淋巴结外的侵犯,血清钙正常,最终根据体液细胞学、流式细胞免疫表型、病理活检和影像学检查明确诊断为浆母细胞性淋巴瘤。
检验案例分析
2021-08-07首次入院。入院前门诊查PET-CT提示提示右侧子宫附件区及全身淋巴结肿大并代谢增高,考虑右侧卵巢癌伴多发转移可能性大。
2021-08-08血清肿瘤标志物检测示“糖类抗原125:616.30U/mL、糖类抗原15-3:150.6U/mL、神经元特异性烯醇化酶:33.27ng/mL、人附睾蛋白4:118.9pmol/L、β-绒毛膜促性腺激素:215.3mIU/mL”。
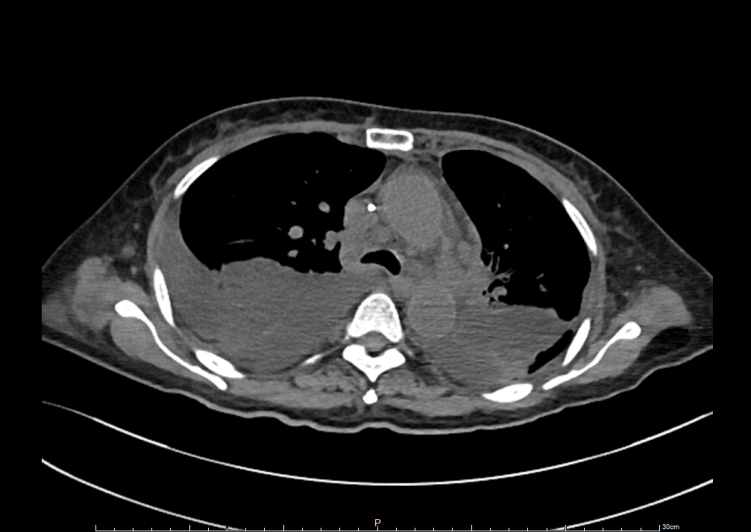
2021-08-08肺部CT提示右侧胸腔积液。给予抗感染、引流胸腔积液后患者气促好转,未待胸水病理结果报告就拒绝进一步诊治办理出院。
2021-11-23患者因气促、腹胀、腹泻再次入院,肺部及腹部CT提示双侧胸腔积液,心包积液及盆腔积液,左侧子宫附件区新发占位,结合首次入院影像学检查结果收入妇产科。
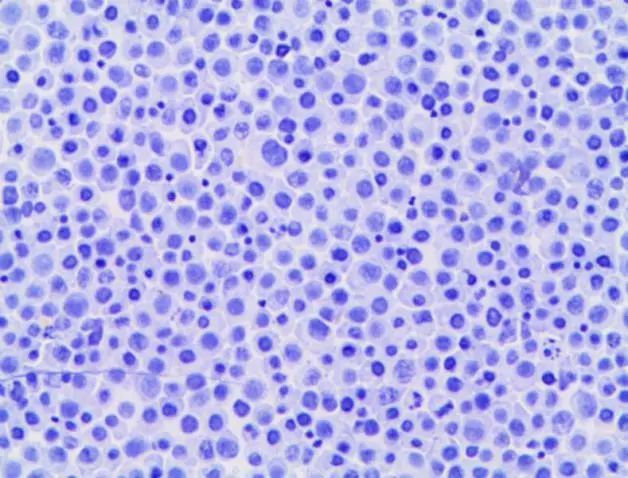
2021-11-24胸水常规及细胞学检查(见图A、B):呈渗出性改变,白细胞数显着升高且以单个核细胞为主;可见原始浆细胞样异常细胞。

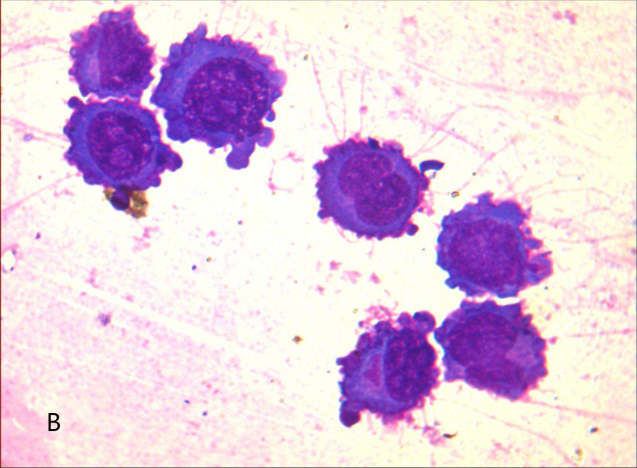
鉴于体液形态学上判断淋巴组织肿瘤存在不确定性,故进一步完善胸水流式细胞免疫表型分析(见下图):检出异常浆细胞约94.1%,CD45弱表达或阴性,表达CD38+CD56+,部分弱表达CD19,单克隆表达胞浆Kappa,不表达胞浆Lambda,提示浆细胞肿瘤可能。
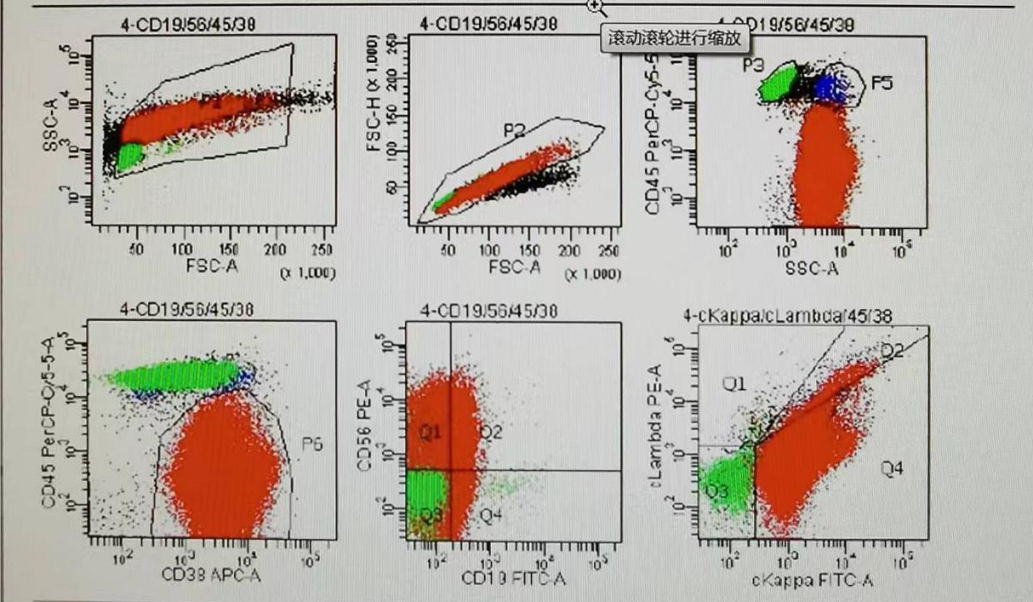
胸水细胞形态学检查和流式细胞免疫表型分析的结果吻合,检验人员立即联系临床,告知患者罹患浆细胞肿瘤可能性大并建议转血液科诊治。患者随后转入血液科诊疗,完善造血与淋巴组织肿瘤的相关检查,具体如下:
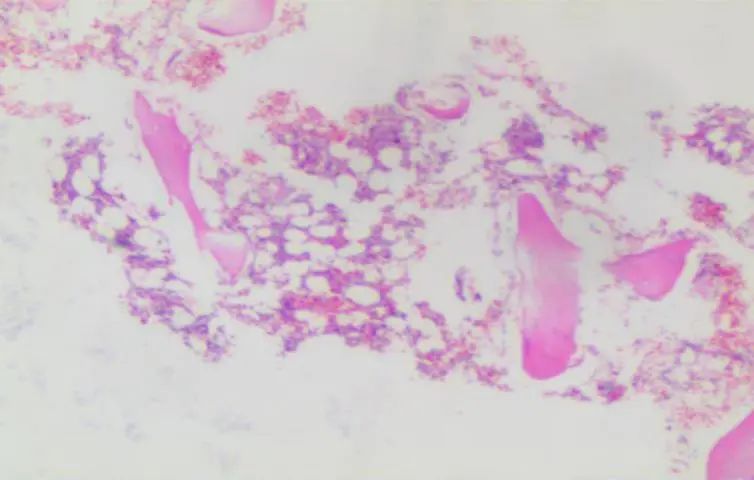
骨髓活检(见下图):未见明确异型细胞。
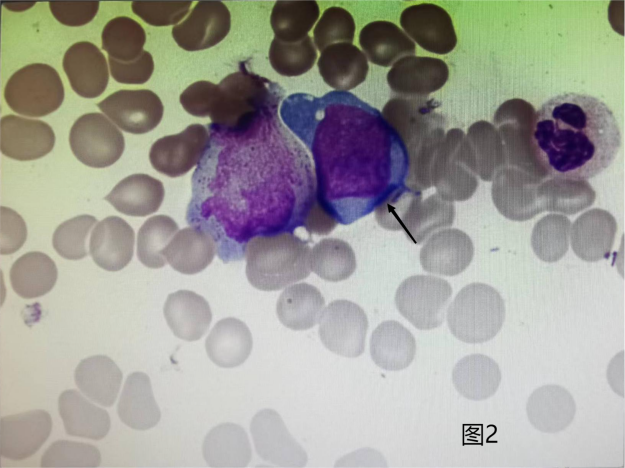
骨髓细胞学检验形态学:首次提示取材欠佳,血稀;第二次(见下图)提示分类不明细胞占2.5%。

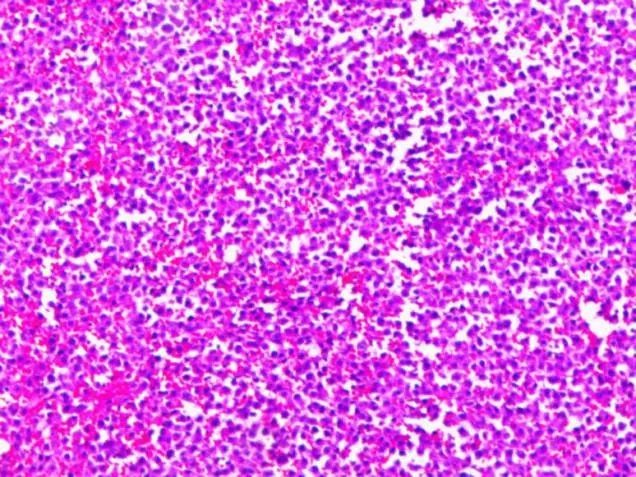
右侧胸腔积液涂片及细胞块病理活检(见下图):考虑淋巴造血系统肿瘤,结合病史及免疫组化,浆细胞肿瘤可能性大。
右髂腰肌肿物穿刺组织活检(见下图)

免疫组化结果:CD38(+),CD138(+),MUM1(+),Kappa(弥漫+),Lambda(少量+),CD3(-),CD5(-),CD20(-),CD79a(-),CD99(-),WT-1(浆+),MyoD1(-),Desmin(-),SYN(-),CgA(-),CD56(+),INI-1(+),CK-P(-),Ki-67(80%)。
结合临床及免疫组化,考虑为浆细胞肿瘤,肿瘤累及横纹肌组织。建议临床进一步做基因检测除外浆母细胞淋巴瘤或伴有浆细胞分化的淋巴造血系统肿瘤。
免疫固定电泳:未见异常单克隆条带。
体液免疫监测:IgG 22.55g/l,余免疫球蛋白水平正常。血κ轻链5.27g/L、血λ轻链3.62g/L,κ/λ比率1.46。尿κ轻链18.1mg/L,尿λ轻链6.93mg/L,κ/λ比率2.61。
初步诊断:浆母细胞性淋巴瘤
知识拓展
浆母细胞淋巴瘤(PBL)是一种临床罕见的B细胞淋巴细胞增殖性疾病,其淋巴结外病变非常常见,最常累及部位仍为口腔或下颚、胃肠道、鼻副窦、骨髓、皮肤及肺。PBL肿瘤细胞呈类似免疫母细胞的大B细胞弥漫性增殖并表达浆细胞相关抗原,而缺乏成熟B细胞标记,多发生于HIV感染人群,近来越来越多的临床研究报道其与免疫功能抑制有关。
2016年WHO淋巴造血系统肿瘤分类将PBL作为大B细胞淋巴瘤独立亚型,并认为与HIV和EB病毒感染有关,或与其他免疫缺陷状态相关。该疾病容易与其他淋巴瘤如浆母细胞样骨髓瘤、原发性渗出性淋巴瘤、弥漫大B细胞淋巴瘤、Burkitt淋巴瘤等混淆,恶性程度较高,复发率高,多数预后不良。
PBL镜下特点为弥漫浸润的中等偏大肿瘤样淋巴细胞弥漫性浸润生长,肿瘤细胞圆形或椭圆形,呈免疫母细胞样或浆母细胞样,胞浆较为丰富,偶见核周空晕。在形态上PBL与浆母细胞样骨髓瘤很难鉴别,流式细胞免疫表型也很相似,两者鉴别需要综合临床判断,若患者出现溶骨性破坏、高钙血症、骨髓受累、肾功能障碍、血清免疫球蛋白升高等症状,则倾向于浆母细胞性骨髓瘤,反之则为PBL。
而与弥漫大B细胞淋巴瘤和Burkitt淋巴瘤的鉴别可借助流式细胞免疫表型分析加以鉴别,弥漫大B细胞淋巴瘤和Burkitt淋巴瘤的瘤细胞均表达CD19和CD20,不表达异常浆细胞抗原CD138和CD56。
HIV阴性的PBL常被认为是各种原因引起免疫缺陷,常见的发病因素有医源性免疫抑制如器官移植、淋巴增生、自身免疫紊乱或年龄相关免疫抑制等。PBL的病理生理学尚不完全清楚,但已知浆母细胞是起源细胞,它是一种活化的B细胞,经历了体细胞高突变和类别转换重组,并处于正在成为浆细胞的过程。
目前PBL的发病诱因尚不明确,可能与EBV病毒、人类8型疱疹病毒等感染有关,也有研究认为可能与乙肝病毒的感染相关。在分子机制上,目前发现MYC致癌基因的变异与PBL密切相关,最常见的改变是MYC与IG的易位以及MYC的扩增和过表达;此外还有PRDM1的突变以及Blimp1蛋白表达的缺失,这些改变与MYC的过表达有关,此外p53肿瘤抑制分子的表达降低也与本病有关。
HIV阴性的PBL比HIV阳性的PBL预后更差,中位OS为9月,2年OS仅10%,目前没有标准的治疗方案,临床采用联合化疗为主的综合治疗模式。目前较新的治疗还包括靶向、免疫、自体干细胞移植等手段。
案例总结
该患者以胸腔积液,气促为主诉,两次入院分别收入呼吸重症科和妇产科,PET-CT提示右侧卵巢癌伴多发转移可能性大,淋巴瘤待排,建议左侧锁骨上淋巴结活检明确。肿瘤标志物检测提示涉及子宫附件的肿瘤标志物水平升高明显,胸水病理提示淋巴细胞增殖性疾病。
由于影像与病理结果提示不符,患者血清卵巢肿瘤标志物水平明显增高,患者又拒绝深部组织活检,临床确诊一度陷入僵局。在临床常规送检胸水常规生化及培养检查时,细心的检验人员镜下发现一群形态异常的细胞,形似原幼浆细胞,标本及时送流式细胞表型分析,也提示异常细胞为异常浆细胞;故在报告中明确备注并电话联系临床,提出浆细胞肿瘤的重度怀疑并建议完善血液病相关检查。
结合之前胸水病理的提示,临床及时改变诊断方向,逐步完善造血与淋巴组织肿瘤的相关检查,并最终确诊为临床罕见但恶性程度高预后差的浆母细胞淋巴瘤。
通过这个案例,从检验的角度,我们得出三点经验:
淋巴组织肿瘤首发形态学改变的标本类型不一定是骨髓或外周血,可能是各种体液标本和组织标本,所以对细胞形态的认识应涵盖各种标本的细胞形态。就比如该患者外周血细胞形态正常,骨髓细胞形态基本正常,看到的2.5%的分类不明细胞和浆细胞在形态上也有差别,无法通过骨髓细胞形态学提示浆细胞肿瘤的诊断。而骨髓流式分析细胞比例极低,也无法说明问题;但胸水标本无论是常规形态学检查还是流式细胞分析都检出高比例的异常浆细胞,为临床确诊提供方向。
流式细胞免疫表型分析在临床的应用可以进一步验证细胞形态学的结论,能大比例提高血液疾病诊断的符合率,有条件的实验室应两者结合检测。该病例虽然是形态学检验人员事先发现的异常细胞,但如果没有及时进行流式细胞免疫表型分析,检验与临床沟通时就无法明确告知临床异常细胞考虑是浆细胞来源,而没有底气的沟通往往无法令临床信服,也无法令临床及时改变诊断方向。
检验与临床的良好沟通必不可少,良好的临床沟通往往为患者的诊断和治疗赢得时间,也为临床医生减少不必要的工作。
综上所述,造血与淋巴组织肿瘤的诊断需要细胞形态学、细胞免疫表型、细胞遗传学及基因检测(MICM)综合分析。对于PBL这类罕见的淋巴组织肿瘤,除MICM外,往往需要综合临床和影像学检查才能确诊;所以,检验、病理、影像和内外科的多学科合作尤为重要,良好的检验与临床沟通往往为患者的诊断和治疗赢得时间。
专家点评
(厦门大学附属中山医院血液科 鹿全意教授)
血液肿瘤具有临床表现多样性,诊断困难的特点,本例患者以胸腔积液,心包积液为主要表现,常规的细胞学,影像学检查不能明确诊断。作者抓住患者胸腔积液这一特点,进行脱落细胞学相关检查,首先确定了恶性疾病的性质,明确了肿瘤细胞具有浆细胞特点,把诊断聚焦于血液肿瘤,在血液科医生的配合下,经过对病变部位的穿刺活检,及时确定了浆母细胞淋巴瘤的诊断,为患者争取了时间,经过专科治疗病情得到明显控制,说明诊断正确。
病理诊断是诊断肿瘤的金标准,但多数情况下取材困难或多次取材失败,体液的脱落细胞学检查结合流式细胞免疫表型分析具有重要地位,对于肿瘤来源具有提示作用,有针对性的进行细胞学、免疫学、病理学检查及良好的临床沟通为早期诊断肿瘤提供了帮助。
参考文献
[1]刘丹.十六例浆母细胞性淋巴瘤临床分析[D].中国医学科学院北京协和医学院,2020.
[2]许文婧,王佩,马玥诗,等. 60例HIV阴性浆母细胞淋巴瘤患者的临床特征及预后[J].肿瘤防治研究,2021,48(4):375-380.
[3]张天铭,陈琼荣.获得性免疫缺陷综合征伴浆母细胞淋巴瘤1例[J].临床与实验病理学杂志,2022,38(4):511-512.
[4] VALERA A,BALAGUE O,COLOMO L,等. Ig/myc基因重排是浆母细胞性淋巴瘤主要的细胞遗传学改变[J].临床与实验病理学杂志,2011(1):70.
[5]陈晨,周宇红,顾思楠,等. 11例HIV阴性浆母细胞淋巴瘤(PBL)的临床特征分析[J].复旦学报(医学版),2019,46(6):829-833.
[6]桂琳,何小慧,刘鹏,等.九例人免疫缺陷病毒阴性的浆母细胞淋巴瘤临床特征及文献复习[J].中华血液学杂志,2016,37(9):762-767.
[7]韩潇,胡立星,欧阳明祈,等.八例HIV阴性的浆母细胞淋巴瘤患者临床特征及转归[J].中华血液学杂志,2017,38(4):290-294.
[8]戴伊奇,王书楠,国巍,等.硼替佐米治疗人免疫缺陷病毒阴性浆母细胞淋巴瘤3例报告并文献复习[J].第三军医大学学报,2018,40(4):334-339.
[9]冯娟,杨莉洁,陈协群,等. 浆母细胞淋巴瘤的诊治进展[J]. 现代生物医学进展,2016,16(12):2359-2362.
[10]Lopez A, Abrisqueta P. Plasmablastic lymphoma: current perspectives. Blood Lymphat Cancer. 2018 Oct 4;8:63-70.
[11]Damlaj M, Alzayed M, Alahmari B, et al. Therapeutic Potential of Checkpoint Inhibitors in Refractory Plasmablastic Lymphoma. Clin Lymphoma Myeloma Leuk. 2019 Oct;19(10):e559-e563.
[12]Castillo JJ, Bibas M, Miranda RN. The biology and treatment of plasmablastic lymphoma. Blood. 2015 Apr 9;125(15):2323-30.
[13]Witte HM, Künstner A, Hertel N,et al. Integrative genomic and transcriptomic analysis in plasmablastic lymphoma identifies disruption of key regulatory pathways. Blood Adv. 2022 Jan 25;6(2):637-651.
[14]Hertel N, Merz H, Bernd HW, et al. Performance of international prognostic indices in plasmablastic lymphoma: a comparative evaluation. J Cancer Res Clin Oncol. 2021 Oct;147(10):3043-3050.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言






