我国罕见病新药临床试验进展趋势
2023-05-16 田医生 MedSci原创 发表于上海
近10年来,我国罕见病临床试验取得了一定进展。共有481项罕见病临床试验,涵盖了10多种发病率较高的罕见病。
罕见病是一种影响少数人但被认为是全球公共卫生领域优先事项的疾病总称。尽管罕见病发病率低,但对全球人类健康有很大影响,这些疾病的治疗给卫生保健预算带来了巨大负担。
罕见病的定义没有共识,不同地区也不一样。在美国,罕见病被定义为在全国范围内影响不超过200000人的疾病,而在欧洲,其发病率高达万分之五,即大约250000人受到影响。在日本,罕见病是那些影响少于50000名患者的疾病。在中国,最新的罕见病定义是在2021年第三届罕见病/孤儿药定义多学科专家研讨会上发布的。
罕见病被定义为发病率低于1/10000,患病率低于1/10000,患者人数低于140000的疾病。大多数罕见病是慢性的,通常会严重致残,使这些疾病的患者寿命缩短,生活痛苦。
世界各国政府越来越重视罕见病的学术研究和药物投入,尽管有政府政策的推动和社会意识的觉醒,但罕见病临床试验的开展仍然困难重重。
四川大学华西医院的学者团队总结概述了国内罕见病临床试验的特点和发展障碍,已发表在国际杂志上,以期为罕见病领域的后续临床试验提供参考。
近10年来,我国罕见病临床试验取得了一定进展。共有481项罕见病临床试验,涵盖了10多种发病率较高的罕见病。
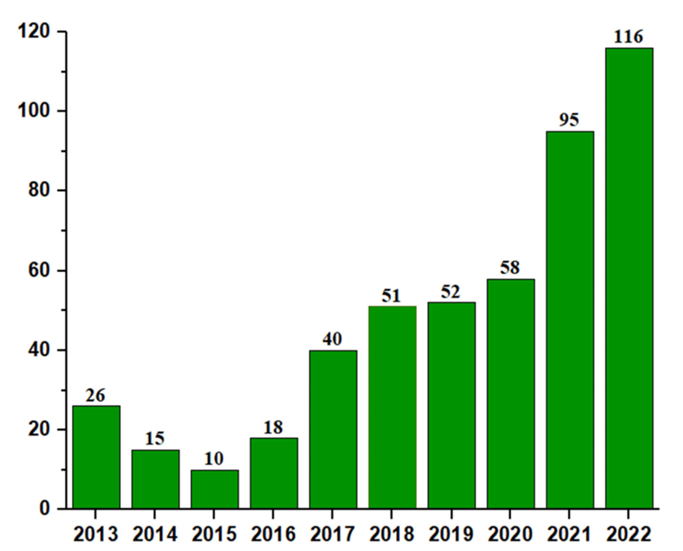
中国罕见病年度临床试验申请数量(图片源于文献)
2013年至2022年平均年增长率为28.2%。由于2015年中国发布了罕见病临床研究的政策文件,2016年罕见病临床试验申请数量较2015年大幅增长80%。此外,大约70%注册临床试验的申请能够如预期招募受试者。尽管如此,与美国、欧洲和日本相比,中国罕见病临床试验的数量较少,婴儿药物的类型仅限于生物制品和化学药物,缺乏其他新的治疗方法。
中国罕见病临床试验数量每年都在稳步增长,这与国家、社会和罕见病患者的支持是分不开的。尽管如此,中国在这一领域与其他发达国家仍有很大差距,这值得进一步研究。
目前国内已经采取了一些措施来促进制药行业的投资,如制定监管政策,使罕见疾病的药物审批更加容易。在过去的几十年里,政府给予罕见病研究和孤儿药开发更大的优先权。
参考文献:
Peng Ai,Fan Xue,Zou Linling et al. Trend of clinical trials of new drugs for rare diseases in China in recent 10 years.[J] .Orphanet J Rare Dis, 2023, 18: 114.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








签到学习
41