帕金森病创新疗法:脑部近红外光靶向激活线粒体功能
2023-01-26 brainnew神内神外 brainnew神内神外 发表于安徽省
近红外(NIR)光生物调节(PBM)被认为是通过增强细胞色素C氧化酶的活性来增强受刺激细胞的线粒体功能,从而阻止PD患者DA神经元的退变。
线粒体是人体中负责能量产生的细胞器,与细胞生物能量的变化密切相关。而帕金森病(PD)中受影响的多巴胺能(DA)神经元由于基础能量需求高,所以特别容易受到能量波动的影响。基于此,科学家们认为线粒体功能障碍是PD发病机制的候选因素之一。
近红外(NIR)光生物调节(PBM)被认为是通过增强细胞色素C氧化酶的活性来增强受刺激细胞的线粒体功能,从而阻止PD患者DA神经元的退变。因此,PBM代表了一种潜在的治疗PD的新方法,但是神经学家们对PBM的神经保护机制的了解还远未完全并且如何将NIR有效地传递到黑质致密部——PD的主要病理部位是充满技术挑战的。
所以,在综述题为Mitochondrial Dysfunction and Parkinson’s Disease-Near-Infrared Photobiomodulation as a Potential Therapeutic Strategy中,来自新加坡国立大学的研究人员们描述了线粒体功能障碍在PD中的作用,PBM如何帮助减轻神经退变过程的最新进展,讨论了使用脑内植入的近红外传输装置的这种治疗方式的临床转译方面,旨在让大家更好的了解上述问题。 1PD的生物能量学与选择性神经元易损性
1PD的生物能量学与选择性神经元易损性
与其他类型的细胞相比,黑质致密部神经元消耗的能量要大得多,因为这些神经元由于其固有的起搏能力,即使在没有外部刺激的情况下也会发射动作电位,而自主起搏依赖的放电延长了这些神经元处于去极化状态的时间,这也相应地增加了依赖ATP的离子泵维持静息膜电位所需的能量。
同时,这些神经元的形态学特征——长、细、少有髓鞘的轴突、具有广泛的终末分支,这样的形态学特征意味着突触终末的数量增加了数倍,这无疑给线粒体运输机制带来了巨大的压力。
黑质致密部DA神经元依赖于钙通道介导的起搏器活动来持续自主放电,而钙通道产生的电流产生宽的动作电位,意味着缓慢的开启/关闭动力学,导致更多的钙离子内流,因此与钠电流相比,细胞内外钙梯度是细胞内外钠梯度的2000倍,所以钙电流的维持能量更高,其钙缓冲机制也更易被破坏,因此黑质致密部的DA神经元也更易受兴奋性毒性的影响。
总之,上述特征导致黑质致密部神经元应对能源危机的能力降低,神经元脆弱性增加。
2线粒体——细胞的能量源泉
前文所提到的神经元统称为能量密集型神经元,它们增加了PD的易感性。线粒体中的氧化磷酸化系统由线粒体电子传递链(ETC)和ATP合酶组成,它们都是位于线粒体内膜的跨膜蛋白,ETC中的复合物细胞色素氧化酶(COX)被认为是催化电子转移中限速步骤的酶。体外实验证明,COX的表达与神经元的活动密切相关。
除了氧化磷酸化的调节外,保持健康的线粒体体积对于细胞中有效能量的产生也是必不可少的。细胞内的线粒体网络不断地被生物发生、融合、分裂和降解,这些过程构成线粒体生命周期,每5-20分钟发生一次。在生理条件下,线粒体生命周期中的事件处于动态平衡状态,维持细胞内线粒体数量的稳定;当然如果细胞代谢需求改变,线粒体网络就会重塑以适应能量需求的变化。
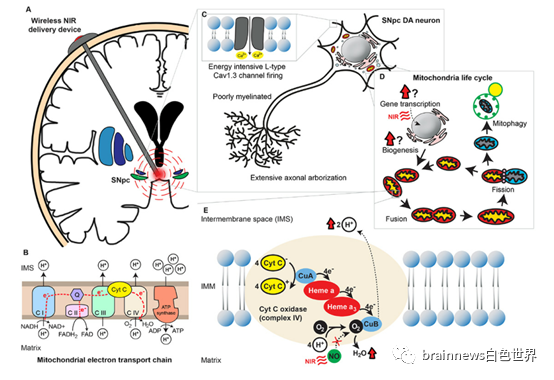 图1. 能量密集型神经元、氧化磷酸化系统和电子传递链、线粒体生命周期
图1. 能量密集型神经元、氧化磷酸化系统和电子传递链、线粒体生命周期
3线粒体功能障碍与PD的关系
研究人员观察到暴露于MPTP中能够迅速发展的PD症状,而MPTP的代谢产物MPP+是一种线粒体复合物Ⅰ抑制剂。无独有偶,作为MPTP研究结果的补充,另外一种线粒体复合物Ⅰ抑制剂鱼藤酮也可以使动物产生明显的PD症状。
而PD患者基因的突变进一步巩固了线粒体功能障碍和PD之间的联系,PINK1和PRKN基因的突变,导致常染色体隐性遗传的早发性帕金森病,它们分别编码与线粒体自噬相关的蛋白PINK1和Parkin。而在散发的PD患者中也发现线粒体DNA突变,这些体细胞突变的数量随着年龄增长而积累,反映了老年受试者PD发病率的增加。同时,由于一些ETC蛋白的转录涉及核和mtDNA的双基因组转录,因此mtDNA突变的积累会削弱线粒体的氧化磷酸化能力。而研究人员们在MitoPark小鼠(在DA神经元条件敲除TFAM)观察到,小鼠出生时是健康的,但随着年龄的增长,他们会出现黑质致密部多巴胺能神经元的渐进性退化和运动迟缓,这与人类PD的自然过程相似。
总之,支持线粒体功能障碍是PD的关键致病过程之一的证据是令人信服的,并促进了人们对于PD作为一种生物能量衰竭疾病的接受。
4近红外光生物调节作为促进线粒体功能的一种策略
NIR的治疗特性的发现是相当偶然的——在一个实验中,光动力疗法被输送到啮齿动物的肿瘤细胞,激光的强度被错误地降低,虽然没有达到实验预期的杀瘤效果,但衰减的激光疗法成功地促进了被治疗动物的表面伤口愈合。已有的实验证明,用NIR照射大鼠肝线粒体可增加耗氧量,增加膜电位,促进ATP合成,促进蛋白质合成。而血红蛋白、肌红蛋白和COX是哺乳动物组织中仅有的3个能够吸收NIR的发色团。因此,细胞色素氧化酶成为了NIR效应的明显候选者。
随后的实验结果证实,虽然NIR能够逆转一种钠通道阻滞剂河豚毒素对神经元COX活性的影响,但当河豚毒素被一种有效的COX抑制剂氰化钾取代时,NIR的治疗作用显著减弱。这一结果表明,NIR的PBM有益作用至少部分是通过增强线粒体COX活性来实现的。
5PBM作为一种潜在的PD治疗方案
使用PBM作为PD的一种治疗方法的概念特别诱人,首先支持疾病和干预的机制都集中在线粒体生物能量学的共同主题上;其次,已有研究结果证实长期的PBM给予可以限制星形胶质细胞增生;再次,目前尚无与其使用相关的不良事件发生,这表明它具有强大的安全性;最后,PBM现实的神经保护潜力在PD的药物治疗中是史无前例的。
6推广PBM作为PD神经保护手段的障碍
首先,人们意识到NIR信号强度以每毫米脑组织65%的速度衰减,而与老鼠和小猴子的大脑相比,人类的大脑要大得多并被厚厚的骨性颅骨所遮挡,这无疑给NIR传输到目标区域带来了巨大的挑战。其次,即准确的到达,中脑是人类大脑中一个非常敏感的区域,对任何手术事故都是零容忍的。为了有效的神经保护,它必须在治疗过程中的早期使用,而PD又缺乏有效的早期筛查手段。最后,考虑到PD持续多年,因此PBM面临的另一个挑战是在较长时间内持续提供NIR刺激。
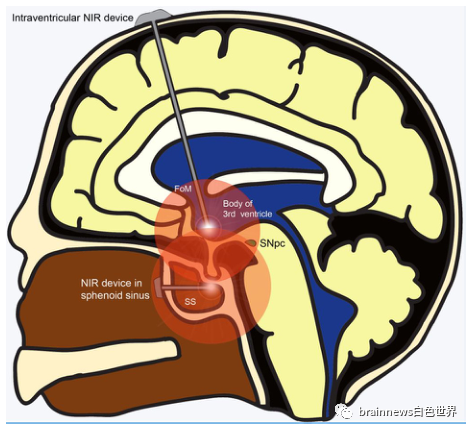
图2. 腹侧中脑以外植入近红外发射装置的可选部位
7总 结
NIR的PBM与PD相匹配的想法是一个极具吸引力的命题,但是其面临的问题——深入的治疗机制、治疗措施的执行还需要科学家们继续深入研究。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












近红外(NIR)光生物调节(PBM)通过增强细胞色素C氧化酶的活性来增强受刺激细胞的线粒体功能是一个极具吸引力的命题
30